Ловля карася осенью » DataLife Engine
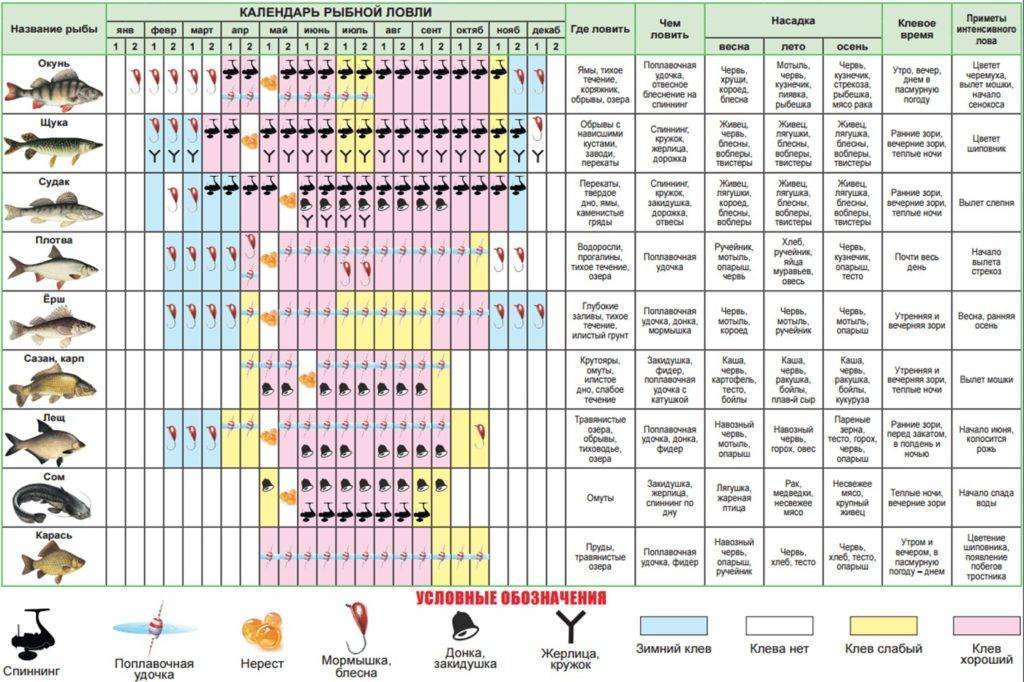
Карась считается «весенне-летней» рыбой, и многие рыболовы полагают, что самое надежное время охоты за ним — это весна, а конкретнее — первые числа мая. Действительно, весенняя, преднерестовая ловля и добычлива, и, главное, весьма интересна. Но так происходит не каждый год, и все зависит от погоды.Карась нерестится порционно, то есть в несколько «заходов», время между которыми определяется погодой, температурой и уровнем воды в данном водоеме. При устойчивой погоде время нереста сокращается. Чем дружнее наступает весна и быстрее приходит лето, тем более предсказуемым, быстрым и эффективным бывает нерест карася. И наоборот, когда погода холодная и неустойчивая, нерест может растянуться на месяц или два. Если такое случается, а это бывает все чаще, то летний клев карася очень кратковременный и неактивный.
К концу лета клев отнерестившейся рыбы обычно стабилизируется. Конец сентября, то есть «бабье лето», обычно радует хорошим клевом карася. Большинство рыболовов знают об этом, но не догадываются о том, что клев может продолжаться и после наступления осенних холодов, вплоть до ледостава. Просто карась начинает клевать очень осторожно.
Большинство рыболовов знают об этом, но не догадываются о том, что клев может продолжаться и после наступления осенних холодов, вплоть до ледостава. Просто карась начинает клевать очень осторожно.
В некоторых водоемах крупный карась прекрасно ловится даже тогда, когда появляются закраины льда. Более того, клев крупного карася может продолжаться и по первому льду. Известны отдельные водоемы, в которых карась продолжает кормиться практически всю зиму. Но сейчас разговор пойдет о ловле в предзимний период.
- Закономерности
Чтобы поймать карася в октябре — ноябре, нужно знать некоторые особенности такой рыбалки. Прежде всего, необходимо правильно выбрать водоем, на котором рыба клюет в это время. Искать такой водоем бывает непросто, поскольку карась очень привередлив. Следует внимательно следить за информацией, постоянно поступающей через знакомых рыболовов, а также опираться на собственный опыт, накопленный в предыдущие годы. Лучше всего прогнозировать осенний клев удается тем рыболовам, которых принято называть «карасятниками».
 Они считают, что если в данном водоеме нет карася, то это безрыбное и бесполезное место.
Они считают, что если в данном водоеме нет карася, то это безрыбное и бесполезное место.Когда достоверной информации об осеннем клеве карася нет, при выборе водоема можно основываться на известной закономерности. Обычно караси лучше всего клюют в тех водоемах, где кроме них не обитает никакая другая рыба, за исключением карпа. Там, где с ними соседствуют плотва, окунь или лещ, караси ловятся намного хуже, и только в определенные дни и часы, несмотря на то что их концентрация может быть весьма приличной. В холодной воде из-за явного сокращения периода активного клева «по-пасть» в нужное время бывает непросто. Наиболее вероятно встретить хороший клев карася в «карповнике», но лишь там, где нет вездесущей форели.
Прочитать статью: где ловить карася
- Погода для карася
Сейчас, как никогда, при выборе места ловли нужно учитывать такой фактор, как на-правление и сила ветра, и помнить, что ветер может изменить направление. Например, вы пришли на известное вам место часа за два до предполагаемого начала клева.
 Расположились, подготовились к ловле, прикормили место, а к ожидаемому часу ветер сменил направление. И все, клева нет и сегодня уже не будет. Очень важно научиться пред-угадывать возможную смену погоды. Такой навык приходит только с годами постоянной практической ловли.
Расположились, подготовились к ловле, прикормили место, а к ожидаемому часу ветер сменил направление. И все, клева нет и сегодня уже не будет. Очень важно научиться пред-угадывать возможную смену погоды. Такой навык приходит только с годами постоянной практической ловли.Когда ветер теплый и не меняет направление, нужно выбирать прибойный берег. Очень хорошо, если идет теплый дождь, но тогда карась может подняться вполводы, то есть не совсем вполводы, а приблизительно на 20 см выше дна при глубине 2 м. Интересно, что в такие моменты он проявляет активность, кормится и вероятность клева очень высока. К сожалению, такое случается крайне редко и чаще к вечеру.
Практика показывает, что в относительно тихую погоду карась обычно ловится до самого ледостава, уходя во все более глубокие места, и в конце концов концентрируется в ямах, где его можно достать только дальним забросом или пикером.
Прочитать статью: на что осенью ловить карася
- Целесообразность применения штекера
Вблизи берега наиболее эффективна штекерная снасть, которая позволяет использовать тонкую, легкую, а в зависимости от условий и сверх¬легкую оснастку.
 Штекер дает возможность удерживать оснастку в точке ловли, то есть ловить практически способом «полудонка».
Штекер дает возможность удерживать оснастку в точке ловли, то есть ловить практически способом «полудонка».В качестве оснастки я почти всегда использую «уклеенный» вариант с леской не толще 0,1 мм и поплавком грузоподъемностью не более 0,4 г. В предзимье это важно, несмотря на то что карась может клевать достаточно активно. Поплавок выбираю с довольно тяжелым килем, чтобы без дополнительной огрузки он сразу принимал в воде вертикальное положение. Это удобно, поскольку если приманка легкая, то приходится ставить грузило-подпасок, а когда приманка тяжелая, его можно не устанавливать.
Во время ловли в штилевую погоду весьма эффективно использовать тонкие и длинные поплавки типа «игла», поскольку с их помощью наиболее просто определять тот горизонт ловли, на котором сейчас кормится карась. Длинная и тонкая антенна с небольшой грузоподъемностью позволяет увидеть момент, когда приманка опустится. Особенно это хорошо заметно, если используется червь или крупная перловка. Видно даже, когда приманка касается дна и ложится на него.
Важно бесшумно и медленно опустить приманку в выбранную точку, подождать несколько секунд и так же тихо переместить оснастку немного в сторону. Такая техника ловли оправданна, когда карась активен.
Если поклевки редкие и осторожные, имеет смысл опустить приманку на дно и удерживать ее на месте до поклевки.
Если карась приличного размера ловится на червя, то приманку и подпасок лучше положить на дно и отрегулировать спуск так, чтобы оснастку не сносило ветром и волной. Ловить маховым удилищем в холодной осенней воде, когда карась клюет в определенной точке, весьма трудно технически. Малейшее дуновение ветра приводит к тому, что оснастка смещается с точки, где наблюдаются поклевки. Перезаброс оснастки настораживает рыбу. Происходит постоянная потеря времени, так как приходится ждать, когда рыба успокоится. К тому же при ловле крупного карася «махом» рыболов вынужден использовать более грубые оснастки. В целом ловля карася осенью очень напоминает ловлю плотвы, когда стая занимает какое- то место, которое нужно найти или вычислить, активировать рыбу прикормкой и преподнести ей на тонкой оснастке соблазнительную приманку.
 Причем в нужное время.
Причем в нужное время.В конце октября — начале ноября в стоячих водоемах обычно ночью появляются первые закраины льда. Наступает время охоты за крупным, а нередко и рекордным карасем.
Как только появляются закраины, начинается очень добычливая ловля этой рыбы на ямах. Дистанция ловли нередко достигает 25 м и более, а глубина — 3-5 м, поэтому оптимальной становится снасть для дальнего заброса со скользящим поплавком.
Ничего особенного в оснастке нет. Обычный скользящий поплавок грузоподъемностью 3+5 или 4+6 г на леске диаметром 0,18 мм. Поводок — длиной 15-20 см из лески диаметром 0,12-0,14 мм. Подпасок подбирается такой, чтобы он мог удерживать оснастку, если ее придется заякорить. Из приманок лучше всего крупный мотыль на крючке № 16-18. Интересно, что почти любая прикормка в большинстве случаев действует отрицательно. Единственная надежная прикормка готовится из того же крупного мотыля, смешанного с землей или суглинком. Чтобы доставить небольшие (размером с шарик для настольного тенниса) порции прикормки в точку ловли, нужно использовать рогатку. Несмотря на все сложности та¬кой ловли, если вам удастся сделать все правильно и по-пасть на клев, то результативность рыбалки с лихвой окупит все усилия.
Несмотря на все сложности та¬кой ловли, если вам удастся сделать все правильно и по-пасть на клев, то результативность рыбалки с лихвой окупит все усилия.
Андрей Яншевский
Осенняя рыбалка на карася — Пенсионеррб. Все о пенсии
От времени суток клев тоже зависит. В летнее время наиболее активно клюет в рассветные часы. После этого активность снижается, но не кардинально. Бывают дни, когда карась активно клюет на всем протяжении светового дня. Весной и осенью особой активности в рассвет или ближе к закату не наблюдается. Клев ровный на протяжении всего дня. Даже несколько усиливается ближе к обеду.
Успешная рыбалка на карася зависит еще и от используемой прикормки и наживки. Для прикормки я использую специальный состав для карася, купленный в магазине. Добавляю в него ароматизатор и наживку, на которую собираюсь ловить. В основном для наживки использую перловку, опарыша или червя. Летом на червя клюет получше, но мелкий. На перловку – более крупный. Удочку в насаженной перловкой использую для дальнего заброса.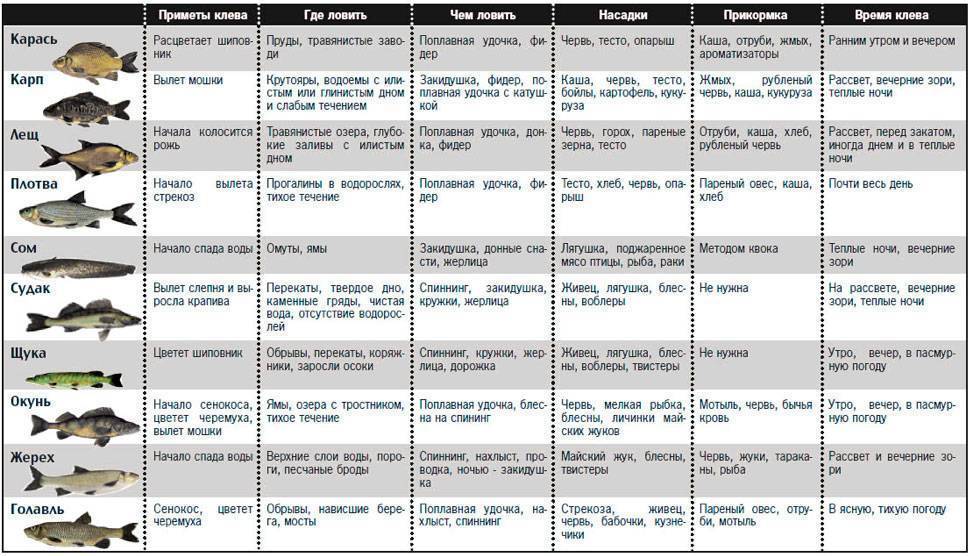 С червем – ближе к берегу. Стараюсь выбирать место, заросшее водорослями, но не сильно, а то снастей не напасешься. Закидываю как можно ближе к водорослям.
С червем – ближе к берегу. Стараюсь выбирать место, заросшее водорослями, но не сильно, а то снастей не напасешься. Закидываю как можно ближе к водорослям.
Летом карасю особой разницы нет на что клевать – на растительную наживку или червя. Но вот осенью он больше предпочитает червя или опарыша. Причем берет на него не только мелкий, но и достаточно крупный. При этом активность в принципе одинакова и возле берега и на дальний заброс.
Клев карася осенью несколько отличается от того, как он ведет себя летом. Слету наживку не хватает. Берет медленно, осторожно. Поэтому не стоит подсекать при каждом движении поплавка. Лучше дождаться, когда хорошо возьмет. Есть еще и проблема – мелочь, которая «гоняет» крючок с наживкой, понемногу отъедая от червя и атакует поплавок. Чтобы мелкий карась не сдернул червя полностью я «придавливаю» его перловкой, насаживая одно зерно на крючок после червя.
Подытоживая мои наблюдения для более успешной осенней рыбалки на карася можно выделить несколько советов:
- прикормку использовать «магазинную», но добавлять туда перловку и червя, можно — ароматизатор;
- перловку на прикормку варить минут 40, после чего добавить в нее нерафинированного подсолнечного масла.
 Можно запаривать перловку в термосе;
Можно запаривать перловку в термосе; - место выбирать заросшее водорослями, но не слишком. Закидывать в «окна» или за водоросли. Дальность заброса роли не играет;
- время суток для осенней рыбалки на карася особой роли тоже не играет. Отправляйтесь на рыбалку тогда, когда удобнее;
- для наживки использовать червя. Можно на этот же крючок добавить зерно перловки;
- сразу не подсекать, дождаться, когда карась хорошо возьмет наживку.
Успех осенней рыбалки на карася зависит от конкретного водоема. Для одного водоема вышесказанные советы справедливы в полной мере, для другого – частично, а может быть для какого-то озера они и вовсе не работают. Поэтому необходимо пробовать различные варианты и выбирать свои, основываясь на личном опыте.
Читайте также: поддержание порядка и чистоты в доме
льготную пенсию придется оформлять через суд
самое главное — здоровье
Ловим рыбу в сентябре — Готовим на природе
В начале осени теплая погода, рыба активна. Что еще нужно рыбаку? В этой статье расскажу Вам, как ловить разную рыбу в сентябре. Рыба в сентябре часто уходит на глубину для поиска пищи. Осенью лучше не ловить только на одном месте, а менять разные места. Лучше всего делать дальние забросы и ловить рыбу с лодки. Тогда шансы поймать побольше рыбы увеличиваются. Хорошо осенью ловить рыбку на спиннинг. Для наживки используйте червя, мотыль, опарыша. А хищника ловите на живца.
Что еще нужно рыбаку? В этой статье расскажу Вам, как ловить разную рыбу в сентябре. Рыба в сентябре часто уходит на глубину для поиска пищи. Осенью лучше не ловить только на одном месте, а менять разные места. Лучше всего делать дальние забросы и ловить рыбу с лодки. Тогда шансы поймать побольше рыбы увеличиваются. Хорошо осенью ловить рыбку на спиннинг. Для наживки используйте червя, мотыль, опарыша. А хищника ловите на живца.
Что касается прикормки, то она не должна быть сильно ароматизированной. Осенью сильные запахи скорее отпугивают рыб, чем привлекают. В тихие пасмурные денечки особенно хорошо идет ловля. Также рыба хорошо клюет в теплую безветренную погоду.
В такое время года плотва в прудах и озерцах ловится хорошо на мотыля, а окунь на малька. Карп и лещ также берут на червя и мотыля. Голавль ловится на куриные кишки и на пескаря. Налим лучше ловится ночью. Щуку ловят спиннингом. У щуки в этот период начинается осенний жор на глубоких местах. Судака ловят отвесным блеснением в глубоких ямах.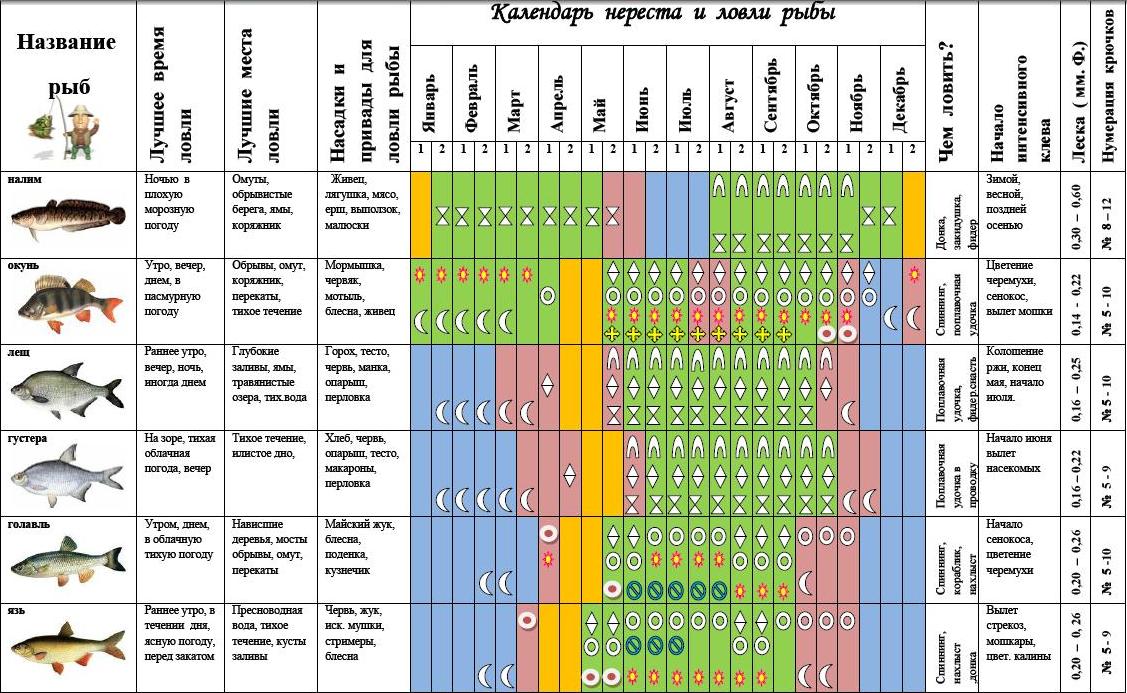 На озерах ловят на кузнечика. А в маленьких речках можно ловить на мормышку. За хорошей щукой отправляются на глубину. Обычно рыбу ловят с лодки. Применяют для ловли спиннинг, дорожку, кружки и поплавочную удочку. Щука в сентябре питается и большими приманками.
На озерах ловят на кузнечика. А в маленьких речках можно ловить на мормышку. За хорошей щукой отправляются на глубину. Обычно рыбу ловят с лодки. Применяют для ловли спиннинг, дорожку, кружки и поплавочную удочку. Щука в сентябре питается и большими приманками.
На окуня в этот период удачнее всего рыбачить вечером или ранним утречком. Используют спиннинг и поплавочную удочку. Более всего окунь в это время водится вдоль берега и на свалах в глубине. Для приманки используют попперы, твистеры, воблера, блесна вертушки. Что касается мормышек то лучше всего использовать уралки, чертики и муравьев.
В сентябре особенно удачно можно ловить судака. Удачнее всего судак ловится ночью. В виде живых насадок подойдут ерши, пескари, ельчики, подлещики. Используют джиговые приманки, силиконовые виброхвосты, поролоновые рыбки, твистеры.
В сентябре днем еще тепло. Всякие жуки и личинки в зарослях привлекают карася к себе. Для насадки можно использовать червя или опарыша, а когда и все вместе. В середине сентября холодает, и карась идет на глубину.
В середине сентября холодает, и карась идет на глубину.
В сентябре хорошо клюет лещ. Он держится в ямах, заводях и в местах в которых есть илистое дно. Особенно хорошо ловится лещ в безветренную погоду, на закате или ранним утром. Используйте прикормку для рыбалки.
Что касается карпа, то в сентябре он очень хорошо клюет и почти на любую наживку. Для рыбалки лучше всего взять червя, опарыша, хлебные катыши, геркулесовую кашу с сахаром, моллюск, ароматизаторы корицы или арахиса. Ловят карпа и при помощи простых поплавочных удочек и донных. Поплавок пусть будет не слишком заметен, чтобы не смущать рыбу.
Плотва в сентябре идет на глубину, она ищет себе ямки. Ловят плотву на мотыля, водных личинок, червя, насекомых. Также можно половить на стрекозу, личинку ручейника. При крупной плотве насаживают много личинок. Замечательной наживкой можно считать окуклившуюся личинку опарыша. Удачной Вам рыбалки в сентябре!
Карась | Советы рыбакам
Карась это рыба семейства карповых рода карасей. В наших водоемах встречаются два представителя этого вида известные рыболовам под названиями «серебряный» и «золотой».
В наших водоемах встречаются два представителя этого вида известные рыболовам под названиями «серебряный» и «золотой».
Золотого карася сегодня можно встретить все реже и реже. Из водоемов его вытесняет более проворный и адаптированный серебряный. Отличий в питании этих двух видов практически нет, поэтому выбрать какого карася поймать практически не возможно.
Ловля весной
В весеннее время ловлю карася обычно начинают с последних недель апреля. В это время он уже проснулся и начинает активно искать корм после спячки. Бывает так, что весна приходит рано, и в этом случае необходимо ориентироваться на температуру.
Ловлю карася ранней весной можно начинать через неделю после схода льда. Так же необходимым условием является прогрев воды хотя бы до 5 градусов. Но в водоемах с твердым дном карась может клевать и при отрицательной температуре.
Пик активности этой рыбы приходится на конец апреля и начало мая, когда начинает появляться подводная растительность, а с ней и микроорганизмы, составляющие рацион карася. В это время карася можно ловить буквально руками, так как он подплывая к траве, часто застревает на мели.
В это время карася можно ловить буквально руками, так как он подплывая к траве, часто застревает на мели.
В середине мая у карася начинается нерест, но в зависимости от погодных условий, он может надолго затянуться. Как правило, если в мае стоит хорошая солнечная погода, а температура воды достигает 15 градусов, то можно с уверенностью сказать, что в первых числах июня у него начнется жор.
Ловля летом
Летняя ловля карася намного сложнее, чем весной, и шансы поймать трофей летом не велики. В первый месяц лета сложнее всего, нужно обращать внимание на размеры и глубину водоема. Вода могла не прогреться достаточно и тогда клев будет вялым.
Июль более благоприятен для рыбалки. Сейчас можно сказать наверняка, что карась уже отнерестился и активно питается. Тем не менее в этот месяц успех сильно зависит от времени ловли.
Пик клева приходится на утренние часы примерно до 8-9 утра и вечернее время с 7-8 часов и до заката. Так же следует отметить, что в июле в солнечные дни хорошо ловится молодь карася, конечно, это не трофеи и даже не «ладошечники», но в качестве живца они подойдут идеально.
В августе приходят холодные ночи и время клева карася сдвигается на несколько часов в зависимости от температуры. Чем ближе к сентябрю, тем позже начинается активный клев.
Ловля осенью
В сентябре температура воды падает, и подводная растительность начинает отмирать. В этом месяце карась собирается в стаи и ищет корм. Залогом успеха рыбалки является правильно выбранное место.
К слову сказать, именно в сентябре мне чаще всего попадаются трофейные особи, вот например карасик прошлого сентября на 1 кг:
Октябрь не редко оставляет рыбаков без улова. Обусловлено это резкими скачками атмосферного давления, к которому чувствительна любая рыба. На удачу следует рассчитывать в первой половине этого месяца, когда карась еще питается.
В середине осени следует использовать некрупные животные приманки, мотыля, опарыша, и мелкого червя. Ловлю следует производить на значительной глубине, где присутствует ил. Именно там карась ожидает морозов.
Ноябрь чаще всего сопровождается ночными морозами и не высокой температурой в дневное время. Рассчитывать на поимку трофея не приходится, так как крупные особи уже практически спят.
Рассчитывать на поимку трофея не приходится, так как крупные особи уже практически спят.
Лишь неглубокие водоемы могут подарить хороший улов, но при условии устоявшегося давления и солнечной погоды в течении 2-3 дней.
Ловля зимой
Зимой, как принято считать, карась впадает в спячку, это и правда и нет. Дело в том, что в водоемах с илистым дном рыба действительно зарывается в ил, и ловить ее бесполезно. А вот в крупных озерах, где присутствует хищник, и водоемах карьерного типа (с твердым дном), карася можно ловить.
В связи с прозрачностью воды, обязательным условием является становление льда. Активизация карася зимой наблюдается в светлые солнечные дни, в остальное время лучше переключится на ловлю другой рыбы.
Почему «Сентябрь» выдерживает: NPR
Если вы когда-нибудь были на свадьбе в США, то знаете, что есть один вопрос, который может заставить всю семью танцевать на танцполе: «Вы помните ночь 21 сентября?»
youtube.com/embed/Gs069dndIYk?rel=0″ frameborder=»0″ allowfullscreen=»»/>
Ютуб
«Сентябрь»Earth, Wind & Fire появляется даже на вымышленных свадьбах, как в начале фильма 1997 года Soul Food .Он появился в телешоу, рекламных роликах, спортивных мероприятиях и видеоиграх. HBO назвал фильм в честь песни. В 2008 году он играл на съездах республиканцев и демократов.
История песни начинается в 1978 году. Allee Уиллис была бедным автором песен в Лос-Анджелесе, пока однажды ночью ей не позвонил Морис Уайт, лидер Earth, Wind & Fire. Уайт предложил ей шанс всей жизни: стать соавтором следующего альбома группы. Уиллис прибыл в студию на следующий день, надеясь, что это не какая-то космическая шутка.
«Когда я открываю дверь, они только что написали вступление к «Сентябрю». И я просто подумал: «Боже мой, пусть это будет то, что они хотят, чтобы я написал!» Потому что это явно была самая счастливая песня в мире», — говорит Уиллис.
И я просто подумал: «Боже мой, пусть это будет то, что они хотят, чтобы я написал!» Потому что это явно была самая счастливая песня в мире», — говорит Уиллис.
Используя последовательность, составленную гитаристом Earth, Wind & Fire Элом Маккеем, Уайт и Уиллис написали песню в течение месяца, создавая образы ясного неба и танцуя под звездами. Уиллис говорит, что ей нравятся песни, рассказывающие истории, и что в какой-то момент она испугалась, что текст «September» начал звучать упрощенно.Одна вздорная фраза особенно ее взбесила.
«Фраза, которую Морис использовал в каждой написанной им песне, была «ba-dee-ya», — говорит она. «Итак, с самого начала он пел: «Ба-ди-я, скажи, ты помнишь / Ба-ди-я, танцующая в сентябре». И я сказал: «Мы, , собираемся заменить «ба-ди-я» на настоящие слова,
Неправильно. Уиллис говорит, что на последней вокальной сессии она отчаялась и умоляла Уайта переписать партию.
«И, наконец, когда стало настолько очевидно, что он не собирается этого делать, я просто сказал: «Что, черт возьми, означает «ба-ди-я»?» И он, по сути, сказал: «Кого, черт возьми, это волнует?», — говорит она. «От него я получил свой величайший урок в написании песен: никогда не позволяйте лирике мешать ритму».
Я спросил Джеффри Переца, профессора теории музыки в Институте Клайва Дэвиса при Нью-Йоркском университете, что делает этот грув таким мощным. Он говорит, что во многом это связано с тем, как раскрывается музыка.Сама структура песни представляет собой бесконечный цикл, который заставляет нас танцевать и желать большего.
«В припеве есть четыре аккорда, которые просто продолжают двигаться вперед и, кажется, никогда никуда не приземляются — так же, как четыре времени года», — говорит он. «Это конец лета, это начало осени, это бабье лето, это переход от теплого к прохладному».
Спусковым крючком для этого страстного чувства, по словам Переца, является вступительная строка. Уайт спрашивает: «Ты помнишь?» и мы поставляем воспоминания. Это песня, которая может объединить все поколения, что делает ее идеальной для семейных посиделок. Истинное значение зависит от нас — включая, как говорит Алли Уиллис, эту странно конкретную дату.
Уайт спрашивает: «Ты помнишь?» и мы поставляем воспоминания. Это песня, которая может объединить все поколения, что делает ее идеальной для семейных посиделок. Истинное значение зависит от нас — включая, как говорит Алли Уиллис, эту странно конкретную дату.
«Мы перебрали все даты: «Помните ли вы первую, вторую, третью, четвертую…», и мне больше всего понравилась 21-я, — объясняет Уиллис. «Ко мне постоянно подходят люди, и они так взволнованы, узнав, что это значит.И нет никакого значения, кроме того, что она просто спела лучше, чем любая другая дата. Так что… прости!»
Все в порядке, Алли. Морис был прав. Неважно, что это значит. песня, которая никогда не кончается
Адаптироваться, двигаться или умереть — как тропические коралловые рифовые рыбы справятся с потеплением океана? — Хабари — 2017 — Биология глобальных изменений
Предыдущие исследования приветствовали термостойкость и способность организмов к акклиматизации и адаптации в качестве основных путей выживания видов в условиях изменения климата. Здесь мы бросаем вызов этой теории. За последнее десятилетие было зарегистрировано более 365 видов тропических стенотермных рыб, перемещающихся к полюсу, подальше от горячих точек потепления океана, где температуры на 2–3 °C выше долгосрочных средних значений могут поставить под угрозу критические физиологические процессы. Мы исследовали способность модельного вида — термочувствительной рыбы коралловых рифов, Chromis viridis (Pomacentridae), — использовать поведение предпочтения для регулирования температуры своего тела. Движение потенциально может обойти физиологическую реакцию на стресс, связанную с повышенными температурами, и может быть стратегией, на которую следует полагаться до того, как генетическая адаптация может быть осуществлена.Людей поддерживали при одной из шести температур (23, 25, 27, 29, 31 и 33 °C) в течение как минимум 6 недель. Мы сравнили относительную важность температуры акклиматизации с изменениями верхних критических температурных пределов, аэробного метаболического диапазона и температурных предпочтений.
Здесь мы бросаем вызов этой теории. За последнее десятилетие было зарегистрировано более 365 видов тропических стенотермных рыб, перемещающихся к полюсу, подальше от горячих точек потепления океана, где температуры на 2–3 °C выше долгосрочных средних значений могут поставить под угрозу критические физиологические процессы. Мы исследовали способность модельного вида — термочувствительной рыбы коралловых рифов, Chromis viridis (Pomacentridae), — использовать поведение предпочтения для регулирования температуры своего тела. Движение потенциально может обойти физиологическую реакцию на стресс, связанную с повышенными температурами, и может быть стратегией, на которую следует полагаться до того, как генетическая адаптация может быть осуществлена.Людей поддерживали при одной из шести температур (23, 25, 27, 29, 31 и 33 °C) в течение как минимум 6 недель. Мы сравнили относительную важность температуры акклиматизации с изменениями верхних критических температурных пределов, аэробного метаболического диапазона и температурных предпочтений. В то время как температура акклиматизации положительно влияла на верхний критический тепловой предел, ни аэробный метаболический охват, ни температурные предпочтения не проявляли такой пластичности. Важно отметить, что когда у рыб был выбор остаться в среде обитания, отражающей температуру их акклиматизации, или переселиться, рыбы акклиматизировались к температурам, прогнозируемым на конец века (т.е. 31 или 33 °C) преимущественно искали более низкие температуры, эквивалентные многолетним средним летним значениям в их естественной среде обитания (~29 °C). Это также была температура, обеспечивающая наибольший аэробный метаболический охват и состояние тела при всех процедурах. Следовательно, акклиматизация может придать пластичность некоторым характеристикам продуктивности, но может быть ненадежным индикатором окончательного выживания и распространения мобильных стенотермных видов в условиях глобального потепления. И наоборот, температурные предпочтения могут возникать задолго до того, как пагубное воздействие повышенных температур океана возымеет силу, и сохраняться долгое время после них, и они могут быть основной движущей силой усиливающейся миграции видов к полюсу.
В то время как температура акклиматизации положительно влияла на верхний критический тепловой предел, ни аэробный метаболический охват, ни температурные предпочтения не проявляли такой пластичности. Важно отметить, что когда у рыб был выбор остаться в среде обитания, отражающей температуру их акклиматизации, или переселиться, рыбы акклиматизировались к температурам, прогнозируемым на конец века (т.е. 31 или 33 °C) преимущественно искали более низкие температуры, эквивалентные многолетним средним летним значениям в их естественной среде обитания (~29 °C). Это также была температура, обеспечивающая наибольший аэробный метаболический охват и состояние тела при всех процедурах. Следовательно, акклиматизация может придать пластичность некоторым характеристикам продуктивности, но может быть ненадежным индикатором окончательного выживания и распространения мобильных стенотермных видов в условиях глобального потепления. И наоборот, температурные предпочтения могут возникать задолго до того, как пагубное воздействие повышенных температур океана возымеет силу, и сохраняться долгое время после них, и они могут быть основной движущей силой усиливающейся миграции видов к полюсу.
Тепловой оптимум и толерантность у эвритермных золотых рыбок (Carassius auratus): взаимосвязь между аэробной емкостью всего животного и максимальной частотой сердечных сокращений кривые производительности, полученные из максимальной частоты сердечных сокращений (
f H ), связанные с кривыми для аэробного объема. Для температур акклиматизации 12°, 20° и 28°C оптимальные температуры, полученные из аэробных кривых ( T opt ), составляли 19.9° ± 0,4°, 19,3° ± 0,8° и 28,7° ± 0,8°С соответственно. Температуры точки излома по Аррениусу ( T AB ) для максимума f H составили 21,5° ± 0,6°, 23,8° ± 0,9° и 24,6° ± 0,5°C соответственно. T QB (температура, при которой инкремент Q 10 максимума f H резко снизился ниже 1,9) составлял 24,0° ± 0,7° и 29,8° ± 0,6°C для 12° и 28°C. температуры акклиматизации соответственно и находился в пределах окна T opt (11. 5°–30,3° и 26,9°–30,5°C соответственно), но T QB для температуры акклиматизации 20°C (27,3° ± 0,6°C) выше окна T opt ( 15,4°–23,2°С). При теплой акклиматизации повысилась верхняя критическая температура ( Т крит ; с 37,2° ± 0,7° до 44,7° ± 11,8°С), а также температура, вызывающая сердечную аритмию ( Т обр ; с 31,1°С). ± 0,7° до 39,3° ± 0,4°C). В заключение, мы предлагаем, чтобы максимум f H и связанные с ним температуры перехода скоростей ( T AB , T QB и T arr ) могли быть использованы для верхней тепловой оценки переносимость как эвритермных, так и стенотермных рыб независимо от температуры акклиматизации.Все-таки с такими оценками нужна большая осторожность. Для золотых рыбок, в то время как T AB и T QB всегда находились в пределах окна T opt для 90% максимального аэробного диапазона, а T opt 90 067 был тесно связан с AB для рыбы, акклиматизированной к 12°C, T QB имели наибольшую связь после акклиматизации к 28°C, и оба T AB и T T QB были выше Окно после акклиматизации при 20°C.
5°–30,3° и 26,9°–30,5°C соответственно), но T QB для температуры акклиматизации 20°C (27,3° ± 0,6°C) выше окна T opt ( 15,4°–23,2°С). При теплой акклиматизации повысилась верхняя критическая температура ( Т крит ; с 37,2° ± 0,7° до 44,7° ± 11,8°С), а также температура, вызывающая сердечную аритмию ( Т обр ; с 31,1°С). ± 0,7° до 39,3° ± 0,4°C). В заключение, мы предлагаем, чтобы максимум f H и связанные с ним температуры перехода скоростей ( T AB , T QB и T arr ) могли быть использованы для верхней тепловой оценки переносимость как эвритермных, так и стенотермных рыб независимо от температуры акклиматизации.Все-таки с такими оценками нужна большая осторожность. Для золотых рыбок, в то время как T AB и T QB всегда находились в пределах окна T opt для 90% максимального аэробного диапазона, а T opt 90 067 был тесно связан с AB для рыбы, акклиматизированной к 12°C, T QB имели наибольшую связь после акклиматизации к 28°C, и оба T AB и T T QB были выше Окно после акклиматизации при 20°C.
Chaenocephalus aceratus – обзор
3.1 Состав современной фауны
Несмотря на большую площадь, покрытую Южнополярным морем (> 20 миллионов км 2 ), современная ихтиофауна состоит всего из около 320 видов, принадлежащих до 50 семей (Истман, 2005). Эта антарктическая ихтиофауна уникальна по двум причинам: (i) современная ихтиофауна очень эндемична, 88% всех видов приурочены к Южному полярному морю (Андриашев, 1987), и (ii) в сообществах доминирует один таксономическая группа, подотряд окунеобразных Notothenioidei, на долю которого приходится около 35% всех видов антарктических рыб (Eastman, 1993).В высокогорных районах антарктического шельфа, например в восточной части моря Уэдделла, нототениоиды составляют до 98% общей численности и биомассы рыб (Р. Кнаст и К. Минтенбек, неопубликованные данные). Типичные для рыбных сообществ умеренных или бореальных районов группы, например клюпеиды, отсутствуют. Ненототениоидные виды рыб, обитающие в Южном полярном море, в основном относятся к типичным глубоководным группам, таким как зоаркиды, липариды, макруриды и миктофиды. Распространение этих групп в основном ограничено нижней частью склона и глубоководными участками, где нототениоидные рыбы, за исключением двух Dissostichus spp.( Dissostichus eleginoides и Dissostichus mawsoni ), отсутствуют (Boysen-Ennen, Piatkowski, 1988; Donnelly et al., 2004; Gon, Heemstra, 1990; Kock, 1992).
Распространение этих групп в основном ограничено нижней частью склона и глубоководными участками, где нототениоидные рыбы, за исключением двух Dissostichus spp.( Dissostichus eleginoides и Dissostichus mawsoni ), отсутствуют (Boysen-Ennen, Piatkowski, 1988; Donnelly et al., 2004; Gon, Heemstra, 1990; Kock, 1992).
Около 100 видов нототениоидных рыб были описаны в Южном полярном море (Eastman and Eakin, 2000), но новые виды все еще обнаруживаются (см., например, Eakin and Balushkin, 1998, 2000; Eakin and Eastman, 1998; Eakin et al. ., 2008). Большинство видов принадлежат всего к пяти семействам: Nototheniidae (нототены), Channichthyidae (ледяные рыбы), Artedidraconidae (морские рыбы), Bathydraconidae (рыбы-драконы) и Harpagiferidae (колючие морские рыбы).Эндемизм внутри подотряда чрезвычайно высок: 97% нототениоидных видов встречаются только в Антарктике (Андриашев, 1987).
Разнообразие донных рыбных сообществ различается по регионам, с широтным сдвигом видового состава (Hureau, 1994; Kock, 1992; Mintenbeck et al. , 2003, 2012; Permitin, 1977). В без льда зоны, на подкаругах островных полках, типичные члены мельчайших сообществ Demersal Fish — Chainichthyids Chaenocephalus Aceratus и Champsocephalus Gunnari , Nototheniids PatagonoTothen Guntheri , Gobionotothen Gibberifrons , Lepidonotothen виды, Notothenia spp. и D. eleginoides (патагонский клыкач).
, 2003, 2012; Permitin, 1977). В без льда зоны, на подкаругах островных полках, типичные члены мельчайших сообществ Demersal Fish — Chainichthyids Chaenocephalus Aceratus и Champsocephalus Gunnari , Nototheniids PatagonoTothen Guntheri , Gobionotothen Gibberifrons , Lepidonotothen виды, Notothenia spp. и D. eleginoides (патагонский клыкач).
В более высоких широтах, в зоне сезонного морского льда, в сообществах преобладают Lepidonotothen spp., Notothenia spp., Chionodraco rastrospinosus (Channichthyidae) и некоторые виды рода Trematomus spp. Оро, 2002). На прибрежных мелководьях также многочисленны гарпагифериды Harpagifer antarcticus (Barrera-Oro, 2002; Barrera-Oro and Casaux, 1998).
Донная ихтиофауна высокогорной антарктической зоны характеризуется несколькими видами Trematomus (Nototheniidae), артедидраконидами и батидраконидами, а также чаннихтидами Chionodraco spp. и Cryodraco antarcticus (Donnelly et al., 2004; Eastman and Hubold, 1999; Hubold, 1992; Schwarzbach, 1988). В высокогорных районах антарктического шельфа, таких как восточный шельф моря Уэдделла, видовое разнообразие намного выше, чем на шельфе субантарктических островов или к западу от Антарктического полуострова (Mintenbeck et al., 2012; Шредер и др., 2001). Основными причинами такого высокого видового разнообразия являются трехмерность бентической среды обитания и высокое разнообразие между средами обитания, сформированное севшими на мель айсбергами, что позволяет разделять небольшие ниши (по горизонтали и вертикали) и, таким образом, сосуществовать трофически сходными видами. видов (Brenner et al., 2001; Gerdes et al., 2008; Knust et al., 2003).
и Cryodraco antarcticus (Donnelly et al., 2004; Eastman and Hubold, 1999; Hubold, 1992; Schwarzbach, 1988). В высокогорных районах антарктического шельфа, таких как восточный шельф моря Уэдделла, видовое разнообразие намного выше, чем на шельфе субантарктических островов или к западу от Антарктического полуострова (Mintenbeck et al., 2012; Шредер и др., 2001). Основными причинами такого высокого видового разнообразия являются трехмерность бентической среды обитания и высокое разнообразие между средами обитания, сформированное севшими на мель айсбергами, что позволяет разделять небольшие ниши (по горизонтали и вертикали) и, таким образом, сосуществовать трофически сходными видами. видов (Brenner et al., 2001; Gerdes et al., 2008; Knust et al., 2003).
Пелагическая ихтиофауна Южного полярного моря включает сообщество океанических и неритических рыб.Океанические пелагические сообщества у шельфа в основном состоят из нескольких видов миктофид (Barrera-Oro, 2002; Push et al. , 2004). Неритовое пелагическое сообщество существенно отличается от океанического и крайне бедно видами по сравнению с донным сообществом на шельфе. На рис. 3 эта разница показана на примере сравнения пелагических и придонных рыбных сообществ на восточном шельфе моря Уэдделла на глубине от 200 до 600 м. Сообщество неритических пелагических рыб состоит из очень небольшого числа видов, и большинство из них (например,г. channichthyids Chionodraco spp., Dacodraco hunteri , Neopagetopsis ionah и батидраконид Gymnodraco acuticeps ) на самом деле являются демерсальными рыбами, которые лишь изредка перемещаются в толщу воды. Криопелагическая нототениида Pagothenia borchgrevinki тесно связана с нижней поверхностью льда (например, Janssen et al., 1991) и редко встречается в открытых водах. И в демерсальных, и в пелагических рыбных сообществах отчетливо доминирует один вид нототениевых, антарктическая чешуйница P.антарктикум . Единственным другим видом, достигающим более высокой биомассы в придонном сообществе, является крупная ледяная рыба Chionodraco myersi (рис.
, 2004). Неритовое пелагическое сообщество существенно отличается от океанического и крайне бедно видами по сравнению с донным сообществом на шельфе. На рис. 3 эта разница показана на примере сравнения пелагических и придонных рыбных сообществ на восточном шельфе моря Уэдделла на глубине от 200 до 600 м. Сообщество неритических пелагических рыб состоит из очень небольшого числа видов, и большинство из них (например,г. channichthyids Chionodraco spp., Dacodraco hunteri , Neopagetopsis ionah и батидраконид Gymnodraco acuticeps ) на самом деле являются демерсальными рыбами, которые лишь изредка перемещаются в толщу воды. Криопелагическая нототениида Pagothenia borchgrevinki тесно связана с нижней поверхностью льда (например, Janssen et al., 1991) и редко встречается в открытых водах. И в демерсальных, и в пелагических рыбных сообществах отчетливо доминирует один вид нототениевых, антарктическая чешуйница P.антарктикум . Единственным другим видом, достигающим более высокой биомассы в придонном сообществе, является крупная ледяная рыба Chionodraco myersi (рис. 3). P. antarcticum — эндемичный вид с циркумантарктическим распространением и один из немногих истинно пелагических представителей всего подотряда Notothenioidei. Это мелкий вид (Eastman, 1985a), и взрослые особи совершают суточные вертикальные миграции от морского дна к поверхностным водам (Fuiman et al., 2002; K. Mintenbeck and R.Кнуст неопубликованные данные; Плетц и др., 2001). Этот вид доминирует в биомассе пелагических рыб в прибрежных водах Южного полярного моря более чем на 90% (см. также DeWitt, 1970; Donnelly et al., 2004; Hubold and Ekau, 1987). В южной части моря Уэдделла на долю P. antarcticum приходится большая часть общего производства рыбы, а плотность запаса оценивается как минимум в 1 тонну км 90 169 – 2 (Hubold, 1992). Хотя обычно он встречается в толще свободной воды, его стратегия жизненного цикла, включая динамику питания, по-видимому, тесно связана с морским льдом (Daniels, 1982; La Mesa and Eastman, 2012; Vacchi et al., 2004). Помимо имаго P.
3). P. antarcticum — эндемичный вид с циркумантарктическим распространением и один из немногих истинно пелагических представителей всего подотряда Notothenioidei. Это мелкий вид (Eastman, 1985a), и взрослые особи совершают суточные вертикальные миграции от морского дна к поверхностным водам (Fuiman et al., 2002; K. Mintenbeck and R.Кнуст неопубликованные данные; Плетц и др., 2001). Этот вид доминирует в биомассе пелагических рыб в прибрежных водах Южного полярного моря более чем на 90% (см. также DeWitt, 1970; Donnelly et al., 2004; Hubold and Ekau, 1987). В южной части моря Уэдделла на долю P. antarcticum приходится большая часть общего производства рыбы, а плотность запаса оценивается как минимум в 1 тонну км 90 169 – 2 (Hubold, 1992). Хотя обычно он встречается в толще свободной воды, его стратегия жизненного цикла, включая динамику питания, по-видимому, тесно связана с морским льдом (Daniels, 1982; La Mesa and Eastman, 2012; Vacchi et al., 2004). Помимо имаго P. antarcticum , в сообществе неритических пелагических рыб по численности преобладают личинки и ранняя молодь нескольких нототениоидных видов. В сообществе нототениоидного ихтиопланктона также преобладают ранние стадии жизни P. antarcticum . Личинки нототениоидов в основном концентрируются в верхних 50 м в хорошо стратифицированных поверхностных водах, тогда как молодь встречается в несколько более глубоких водах (Granata et al., 2002; Hubold, 1984, 1985; Hubold and Ekau, 1987; Kellermann, 1986a,b; Моралес-Нин и др., 1998). Из-за их доминирующей роли в антарктических рыбных сообществах в этой главе основное внимание уделяется нототениоидам.
antarcticum , в сообществе неритических пелагических рыб по численности преобладают личинки и ранняя молодь нескольких нототениоидных видов. В сообществе нототениоидного ихтиопланктона также преобладают ранние стадии жизни P. antarcticum . Личинки нототениоидов в основном концентрируются в верхних 50 м в хорошо стратифицированных поверхностных водах, тогда как молодь встречается в несколько более глубоких водах (Granata et al., 2002; Hubold, 1984, 1985; Hubold and Ekau, 1987; Kellermann, 1986a,b; Моралес-Нин и др., 1998). Из-за их доминирующей роли в антарктических рыбных сообществах в этой главе основное внимание уделяется нототениоидам.
Рис. 3. Состав пелагических и донных рыбных сообществ на восточной части шельфа моря Уэдделла на глубине от 200 до 600 м (выборки из 26 выборок выдрового трала и 10 выборок бенто-пелагической сетью, взятых в период с 1996 по 2004 г.). Только 28 из 49 видов, вносящих вклад > 0,15% от общего количества особей и биомассы показано для демерсального сообщества. Количество видов, видовое богатство, разнообразие и выравненность даны для двух сообществ с использованием различных шкал.
Количество видов, видовое богатство, разнообразие и выравненность даны для двух сообществ с использованием различных шкал.
(PDF) Потери энергии из-за рутинного и пищевого метаболизма у сеголеток молоди атлантической трески (Gadus morhua)
и размер тела (DW) при рутинных метаболических потерях энергии по
атлантической треске по восьми порядкам величины разница в размере
рыбы от личинок до взрослых особей и должна оказаться полезной
там, где для этого вида необходимы средние температурные и размерные значения потери энергии.
Сравнение различных исследований, проведенных на треске
, также показывает, что, хотя диапазон масштабирования RR с размером тела
одинаков у личинок (0.687 до 0,850; Laurence
1978), сеголетки (от 0,677 до 0,761; это исследование),
и более крупные (старшие) молодые и взрослые особи (0,820; Saunders 1963),
измеренные показатели RR личинок значительно более изменчивы.
Это особенно очевидно, когда логарифмически преобразованные скорости
выражены в зависимости от веса (рис. 4b). Изменчивость скорости дыхания
4b). Изменчивость скорости дыхания
личинок может быть важной, неотъемлемой характеристикой этой стадии жизни.Однако изменчивость в
измеренных показателях RR может быть результатом ряда источников, включая
различные методологии (например, протоколы и оборудование), а также
физиологические различия между поголовьями (например, Hunt von-
Herbing and Boutilier 1996). . Учитывая изменчивость скорости метаболизма
личинок и ожидание того, что скорость метаболизма
личинок может
масштабироваться по-разному в зависимости от размера тела и температуры, чем у
молодых и взрослых особей (e.g., Post and Lee 1996), более строгий анализ, выходящий за рамки данного исследования, представляется оправданным. Такой анализ был бы особенно полезен, поскольку
усилия по моделированию личинок трескунок (например, Werner et al. 1996;
Hinrichsen et al. 2002) опираются на эти данные (см. Buckley et al.
2000).
В заключение, результаты настоящего исследования свидетельствуют о био-
энергетических различиях между сеголетками и
более крупной (старшей) молодью и взрослой треской (например,
).г., различные алло-
метрические масштабные коэффициенты, потери энергии в результате кормления,
и температурных воздействий). Различия в физиологии
трески и других видов рыб с разным размером и возрастом
являются, вероятно, результатом механизмов, действующих на повышение эффективности роста в раннем возрасте. Эффективность роста обычно выше
у более мелких и молодых рыб и снижается с увеличением размера тела у многих видов (Brett and Groves 1979; Keckeis et al.
2001), включая атлантическую треску (Hansson et al. 1996).
Результаты этого исследования подчеркивают необходимость дополнительных базовых физиологических
исследований ранних личиночных и ювенильных стадий
видов морских рыб. Понимание физиологических
ювенильных подростков повышенного энергетического бремени, связанного с относительно высокими показателями соматической активности, связано с повышенной энергетической нагрузкой. рост в среде с
рост в среде с
повышенным риском смертности в результате голода и хищничества.
Благодарности
Полезные комментарии к этой рукописи были получены от
E. Caldarone, E. Durbin и C. Oviatt. Дополнительные респираторные данные
были предоставлены A. Temming и J.-P. Herrmann (Университет
, Гамбург). Инженерную помощь оказали
Э. Рекинтина и Х. Сильвербуш. Мы в большом долгу перед
сотрудниками и вспомогательным персоналом Агентства по охране окружающей среды США — Атлантического отдела экологии и Управления по охране окружающей среды США.S.
Национальное управление океанических и атмосферных исследований – Национальная служба морского рыболовства
(NOAA/NMFS) Наррагансеттская лаборатория –
для доступа к их объектам и их использования. Это исследование было проведено при поддержке NOAA / Университета Род-Айленда Кооператив
Морское образование и исследовательский грант № NA77FE0494 и
Университета Нью-Гэмпшира Грант аквакультуры в открытом океане
№ NA16RP1718.
Ссылки
Бьернссон, Б., и Steinarsson, A. 2002. Скорость роста
атлантической трески (Gadus morhua). Может. Дж. Фиш. Аква. науч. 59:
404–502.
Блейки Х.Б. и Керр С.Р. 1996. Влияние уровня активности на видимое приращение тепла у атлантической трески, Gadus morhua. Может. J.
Рыба. Аква. науч. 53: 2093–2099.
Брандер, К.М. 1995. Влияние температуры на рост атлантической трески
(Gadus morhua L.). ICES J. Mar. Sci. 52: 1–10.
Бретт, Дж. Р., и Гроувс, Т.Д.Д. 1979. Физиологическая энергетика. В
Физиология рыб. Том. VIII. Биоэнергетика и рост. Под редакцией
В.С. Хоар, Д.Дж. Рэндалл и Дж. Р. Бретт. Academic Press, New
York. стр. 279–351.
Buckley, L.J., Lough, R.G., Peck, M.A., and Werner, F.E. 2000.
Модели роста личинок атлантической трески и пикши, метаболизм,
проглатывание и влияние температуры. Может. Дж. Фиш. Аква. науч. 57:
1957–1960.
Кампана, ЮВ 1996. Сила годового класса и скорость роста молоди
Сила годового класса и скорость роста молоди
атлантической трески, Gadus morhua. Мар. Экол. прог. сер. 135: 21–26.
Кампана, С.Э., Франк, К.Т., Херли, П.К.Ф., Келлер, П.А., Пейдж,
Ф.Х., и Смит, П.К. 1989. Выживаемость и численность молоди
атлантической трески (Gadus morhua) и пикши (Melanogrammus
aeglefinus) как показатели силы годового класса. Может. Дж. Фиш.
Вода. науч. 46 (Приложение 1): 171–182.
Эдвардс, Р.Р.К., Финлейсон Д.М. и Стил Дж.Х. 1972. Экспериментальное исследование потребления кислорода, роста и метаболизма трески (Gadus morhua L.). Дж. Эксп. Мар биол. Экол.
8: 299–309.
Фахай, М.П., Берриен, П.Л., Джонсон, Д.Л., и Морс, В.В. 1999. Es-
основной документ о среде обитания рыб: атлантическая треска, Gadus morhua,
история жизни и характеристики среды обитания. Технологии NOAA США. Памятка.
НМФС-НЕ-124.
Фрай, Ф.Э.Дж. 1957. Водное дыхание рыб. В физиологии
рыб. Том. I. Под редакцией М. Э. Брауна. Academic Press, New
Том. I. Под редакцией М. Э. Брауна. Academic Press, New
York. стр. 1–63.
Грин, Э.Дж., и Кэрритт, Д.Э. 1967. Новые таблицы насыщения морской воды кислородом
. Дж. Мар. Рез. 25: 140–147.
Ханссон, С., Рудстам, Л.Г., Китчелл, Дж.Ф., Хилден, М., Джонсон,
Б.Л., и Пеппард, П.Е. 1996. Показатели хищничества североморской трески
(Gadus morhua) — прогнозы на основе моделей эвакуации из желудка и биоэнергетики.ICES J. Mar. Sci. 51: 107–114.
Hinrichsen, H.-H., Möllmann, C., Voss, R., and Kornilovs, G. 2002.
Биофизическое моделирование личинок балтийской трески (Gadus morhua)
рост и выживание. Может. Дж. Фиш. Аква. науч. 59: 1858–1873.
Хант фон Хербинг И. и Бутилье Р.Г. 1996. Активность и метаболизм личинок атлантической трески (Gadus morhua) из шельфовых
исходных популяций ньюфаундленда. Мар биол. 124:
607–617.
Keckeis, H., Kamler, E., Bauer-Nemeschkal, E., and Schneeweiss,
K. 2001. Выживание, развитие и распределение пищевой энергии
2001. Выживание, развитие и распределение пищевой энергии
личинок nase и ранней молоди при различных температурах. J. Fish
Биол. 59: 45–61.
Китс, Д.В., Стил, Д.Х., и Саут, Г.Р. 1987. Роль мясистых
макроводорослей в экологии молоди трески (Gadus morhua L.) в
прибрежных водах восточной части Ньюфаундленда. Может. Дж. Зул. 65: 1273–
1287.
Лоуренс, Г.К. 1978. Сравнительный анализ роста, дыхания и замедленной
пищевой способности личинок трески (Gadus morhua) и пикши
(Melanogrammus aeglefinus) под влиянием температуры во время лабораторных исследований. Мар биол. 50: 1–7.
© 2003 NRC Canada
936 Can. Дж. Фиш. Аква. науч. Том. 60, 2003
J:\cjfas\cjfas60\cjfas6008\F03-079.vp
4 сентября 2003 г. 13:07:54
Цветовой профиль: Отключен
Композитный эффект на экране океана
0 По умолчанию
черный морской окунь (Centropristis striata) аэробный объем и толерантность к гипоксии
Abstract
За последнее десятилетие температура океана на Ю. Юг Северо-восточного континентального шельфа (РЭШ США) нагревается быстрее, чем в среднем по миру, и это связано с наблюдаемыми изменениями распределения северной популяции черного морского окуня ( Centropristis striata ). Механистические модели, основанные на физиологических реакциях на условия окружающей среды, могут улучшить прогнозы пригодности среды обитания в будущем. Мы измерили максимальную, стандартную скорость метаболизма и толерантность к гипоксии (S crit ) у взрослых особей северного черного морского окуня, чтобы оценить производительность в известном температурном диапазоне этого вида.Для получения максимальной скорости метаболизма использовались два метода: погоня и плавательный лоток, чтобы проверить, различаются ли методы, и если да, то влияние на абсолютный аэробный объем. Подмножество особей содержалось при температуре 30°C в течение одного месяца (30 хронических °C) перед экспериментами для проверки способности к акклиматизации. Абсолютный аэробный объем (максимально-стандартная скорость метаболизма) достиг максимума 367,21 мгО 2 кг -1 ч -1 при 24,4°C, в то время как S крит продолжал увеличиваться пропорционально стандартной скорости метаболизма до 30 °С.
Юг Северо-восточного континентального шельфа (РЭШ США) нагревается быстрее, чем в среднем по миру, и это связано с наблюдаемыми изменениями распределения северной популяции черного морского окуня ( Centropristis striata ). Механистические модели, основанные на физиологических реакциях на условия окружающей среды, могут улучшить прогнозы пригодности среды обитания в будущем. Мы измерили максимальную, стандартную скорость метаболизма и толерантность к гипоксии (S crit ) у взрослых особей северного черного морского окуня, чтобы оценить производительность в известном температурном диапазоне этого вида.Для получения максимальной скорости метаболизма использовались два метода: погоня и плавательный лоток, чтобы проверить, различаются ли методы, и если да, то влияние на абсолютный аэробный объем. Подмножество особей содержалось при температуре 30°C в течение одного месяца (30 хронических °C) перед экспериментами для проверки способности к акклиматизации. Абсолютный аэробный объем (максимально-стандартная скорость метаболизма) достиг максимума 367,21 мгО 2 кг -1 ч -1 при 24,4°C, в то время как S крит продолжал увеличиваться пропорционально стандартной скорости метаболизма до 30 °С. Группа 30 хронических °C демонстрировала значительно более низкую максимальную скорость метаболизма и абсолютный аэробный объем по сравнению с группой с краткосрочной акклиматизацией, но стандартная скорость метаболизма или S crit не были затронуты. Это свидетельствует о снижении производительности процессов потребности в кислороде (например, мышечных сокращений) при температуре выше 24 °C, несмотря на поддержание снабжения кислородом. Метаболический индекс, рассчитанный на основе S crit в качестве оценки потенциального аэробного объема, точно соответствовал измеренному факторному аэробному объему (максимальная/стандартная скорость метаболизма) и снижался с повышением температуры до минимума ниже 3.Это может представлять собой критическое пороговое значение для вида. Учитывая, что в ближайшие 80 лет в южной части ареала северной популяции прогнозируется повышение температуры на NES США выше 24 °C, вполне вероятно, что ареал черного морского окуня будет продолжать смещаться к полюсу по мере того, как океан продолжает нагреваться.
Группа 30 хронических °C демонстрировала значительно более низкую максимальную скорость метаболизма и абсолютный аэробный объем по сравнению с группой с краткосрочной акклиматизацией, но стандартная скорость метаболизма или S crit не были затронуты. Это свидетельствует о снижении производительности процессов потребности в кислороде (например, мышечных сокращений) при температуре выше 24 °C, несмотря на поддержание снабжения кислородом. Метаболический индекс, рассчитанный на основе S crit в качестве оценки потенциального аэробного объема, точно соответствовал измеренному факторному аэробному объему (максимальная/стандартная скорость метаболизма) и снижался с повышением температуры до минимума ниже 3.Это может представлять собой критическое пороговое значение для вида. Учитывая, что в ближайшие 80 лет в южной части ареала северной популяции прогнозируется повышение температуры на NES США выше 24 °C, вполне вероятно, что ареал черного морского окуня будет продолжать смещаться к полюсу по мере того, как океан продолжает нагреваться.
Образец цитирования: Slesinger E, Andres A, Young R, Seibel B, Saba V, Phelan B, et al. (2019) Влияние потепления океана на аэробный диапазон и устойчивость к гипоксии черного морского окуня ( Centropristis striata ).ПЛОС ОДИН 14(6): e0218390. https://doi.org/10.1371/journal.pone.0218390
Редактор: Ханс Г. Дам, Коннектикутский университет, США
Поступила в редакцию: 30 января 2019 г.; Принято: 31 мая 2019 г.; Опубликовано: 13 июня 2019 г.
Эта статья находится в открытом доступе, свободна от каких-либо авторских прав и может свободно воспроизводиться, распространяться, передаваться, изменяться, дополняться или иным образом использоваться любым лицом в любых законных целях.Работа доступна в качестве общественного достояния Creative Commons CC0.
Доступность данных: Все соответствующие данные содержатся в рукописи и файлах вспомогательной информации.
Финансирование: Исследование проводилось при поддержке Управления океанических и атмосферных исследований (OAR) Национального управления океанических и атмосферных исследований (NOAA), Программы прибрежных и океанических климатических приложений (COCA) (https://cpo.noaa.gov) , присужденный BS, VS и GS (номер награды NA15OAR4310119).Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Морская среда постепенно нагревается вследствие изменения климата [1]. Вдоль северо-восточного шельфа США (NES США) годовая температура океана повышается быстрее, чем в среднем по миру [2,3], что приводит к быстрому повышению температуры [4,5] с сильным сигналом потепления весной, летом и осенью [4] .Прогнозируется, что в течение следующих 80 лет температура поверхности моря и дна на НЭШ США повысится еще на 4,1°C и 5,0°C соответственно [6,7]. Современное потепление океана на НЭШ США связывают со сдвигами в распространении многих экономически и экологически важных видов рыб как по широте, так и/или по глубине [7–11], связанными с отслеживанием местных климатических скоростей [12]. Понимание и прогнозирование изменений в распределении рыбы будет иметь важное значение для характеристики потенциальных экологических и экономических последствий, а также для прогнозирования и разрешения конфликтов управления рыболовством [13].
Современное потепление океана на НЭШ США связывают со сдвигами в распространении многих экономически и экологически важных видов рыб как по широте, так и/или по глубине [7–11], связанными с отслеживанием местных климатических скоростей [12]. Понимание и прогнозирование изменений в распределении рыбы будет иметь важное значение для характеристики потенциальных экологических и экономических последствий, а также для прогнозирования и разрешения конфликтов управления рыболовством [13].
Температура напрямую влияет на скорость метаболизма морских эктотермов [14,15] и, как полагают, устанавливает границы ареалов видов [16–18]. Одним из объяснений влияния температуры на физиологию экзотермических видов является гипотеза термоустойчивости с ограничением кислорода и емкости (OCLTT; [19,20]), которая постулирует, что температурное ограничение возникает из-за несоответствия потребности в кислороде и его снабжения при субоптимальных температурах. , и может в конечном итоге определить метаболически подходящую среду обитания [21]. В этой связи температурный оптимум возникает там, где абсолютный аэробный объем (ААС), разница между максимальной (MMR) и стандартной скоростью метаболизма (SMR) [22], является самой высокой.SMR — это стоимость содержания организма, которая экспоненциально увеличивается с температурой [15]. MMR первоначально увеличивается с температурой, но может реагировать по-разному при высоких температурах из-за нарушения подачи или использования кислорода. Важно отметить, что измерения MMR могут существенно различаться в зависимости от используемого метода, как правило, исчерпывающей погони или метода плавательного лотка [23,24]. Различные измерения MMR могут повлиять на измерение AAS и, следовательно, на интерпретацию влияния температуры на AAS. Снижение ААС за пределами температурного оптимума связано с разной температурной чувствительностью ММР и СМР [25] и позволяет предположить, что эти температуры субоптимальны.Считается, что ААС представляет собой способность к поглощению кислорода помимо того, что поддерживает поддерживающий метаболизм, и может быть использована для действий, способствующих индивидуальной приспособленности (например, рост, размножение, избегание хищников; [26]).
В этой связи температурный оптимум возникает там, где абсолютный аэробный объем (ААС), разница между максимальной (MMR) и стандартной скоростью метаболизма (SMR) [22], является самой высокой.SMR — это стоимость содержания организма, которая экспоненциально увеличивается с температурой [15]. MMR первоначально увеличивается с температурой, но может реагировать по-разному при высоких температурах из-за нарушения подачи или использования кислорода. Важно отметить, что измерения MMR могут существенно различаться в зависимости от используемого метода, как правило, исчерпывающей погони или метода плавательного лотка [23,24]. Различные измерения MMR могут повлиять на измерение AAS и, следовательно, на интерпретацию влияния температуры на AAS. Снижение ААС за пределами температурного оптимума связано с разной температурной чувствительностью ММР и СМР [25] и позволяет предположить, что эти температуры субоптимальны.Считается, что ААС представляет собой способность к поглощению кислорода помимо того, что поддерживает поддерживающий метаболизм, и может быть использована для действий, способствующих индивидуальной приспособленности (например, рост, размножение, избегание хищников; [26]). Однако следует отметить, что есть исключения из этой гипотезы, обнаруженные у других видов рыб [27–29], включая наши собственные эксперименты, и это несоответствие далее обсуждается в Jutfelt et al. [30]. Тем не менее, адаптивное преимущество жизни при подходящих температурах для поддержания аэробных возможностей может дать механистическое объяснение моделей распределения рыб.
Однако следует отметить, что есть исключения из этой гипотезы, обнаруженные у других видов рыб [27–29], включая наши собственные эксперименты, и это несоответствие далее обсуждается в Jutfelt et al. [30]. Тем не менее, адаптивное преимущество жизни при подходящих температурах для поддержания аэробных возможностей может дать механистическое объяснение моделей распределения рыб.
Общее распределение рыб в значительной степени ограничивается температурными предпочтениями. Доступность кислорода может дополнительно ограничивать метаболически подходящую среду обитания в пределах термальных границ, поскольку растворимость кислорода в окружающей среде снижается с повышением температуры ([31], но см. [32]). В то же время более высокие температуры могут увеличить потребность рыбы в кислороде [33,34], что потенциально может снизить толерантность к гипоксии как из-за снижения растворимости кислорода, так и из-за увеличения потребности рыбы в кислороде [35,36].Устойчивость рыб к гипоксии можно оценить как критический уровень насыщения кислородом (S crit ), который представляет собой % O 2 насыщения воздухом (% O 2 ), ниже которого снабжение кислородом не может соответствовать потребностям поддержания жизнедеятельности.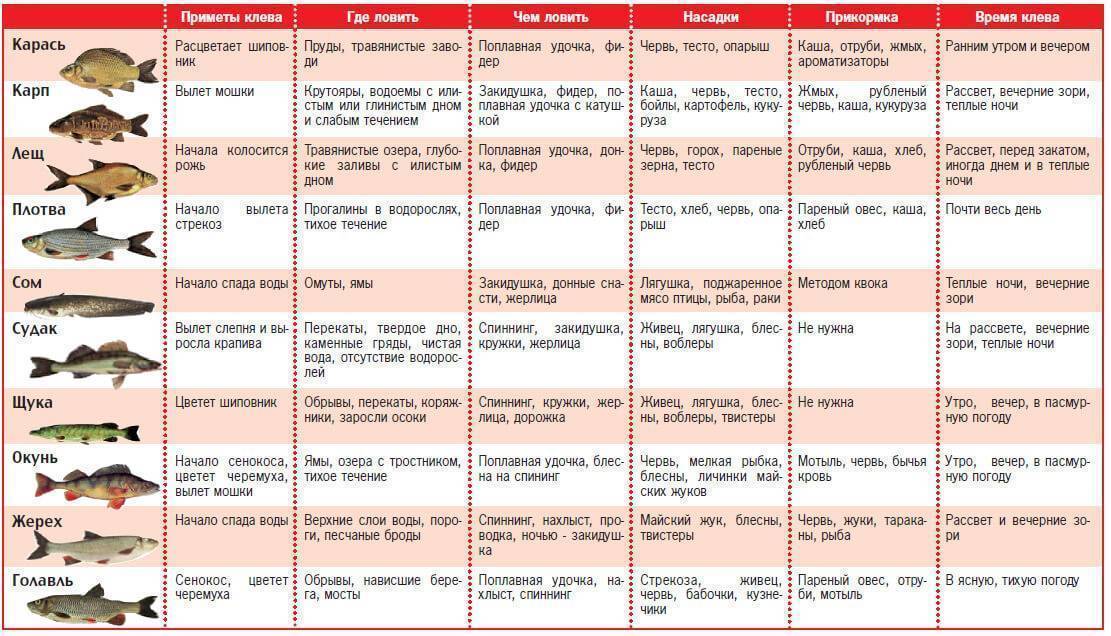 метаболизм. Дальнейшее снижение %O 2 вызывает пропорциональное снижение SMR [37]. Ниже S crit производство АТФ зависит от неустойчивых анаэробных путей, которые могут привести к множеству биохимических проблем, включая накопление анаэробных конечных продуктов и изменения кислотно-щелочного химического состава [38,39], способствуя ограниченному во времени выживанию, если рыба остается в воде с уровнем кислорода ниже S crit .Как правило, считается, что рыба с низким S crit более терпима к более низким устойчивым уровням кислорода [40]. Кроме того, S crit дополнительно обеспечивает средства калибровки метаболического индекса (МИ). Дойч и др. [17] предложили MI как отношение поступления кислорода из окружающей среды к потребности животных в кислороде, что фактически является оценкой усредненной по времени факторной аэробной активности вида. По определению, MI равен 1, когда %O 2 окружающей среды равно S crit .
метаболизм. Дальнейшее снижение %O 2 вызывает пропорциональное снижение SMR [37]. Ниже S crit производство АТФ зависит от неустойчивых анаэробных путей, которые могут привести к множеству биохимических проблем, включая накопление анаэробных конечных продуктов и изменения кислотно-щелочного химического состава [38,39], способствуя ограниченному во времени выживанию, если рыба остается в воде с уровнем кислорода ниже S crit .Как правило, считается, что рыба с низким S crit более терпима к более низким устойчивым уровням кислорода [40]. Кроме того, S crit дополнительно обеспечивает средства калибровки метаболического индекса (МИ). Дойч и др. [17] предложили MI как отношение поступления кислорода из окружающей среды к потребности животных в кислороде, что фактически является оценкой усредненной по времени факторной аэробной активности вида. По определению, MI равен 1, когда %O 2 окружающей среды равно S crit . MI также содержит критерий зависимости от температуры (E o ), который откалиброван по критерию S при заданной температуре и учитывает влияние температуры на соотношение подачи кислорода к потребности рыбы. Минимальный МИ 2–5 указывает на способность окружающей среды снабжать кислородом в 2–5 раз быстрее, чем требуется для поддержания метаболических потребностей в состоянии покоя, и считается поддерживающим для населения. Это определило экваториальную границу распространения для разнообразной группы морских рыб и беспозвоночных (обзор в [17]).Измерение S crit и последующий расчет термочувствительного MI оказались полезными для прогнозирования пригодности среды обитания.
MI также содержит критерий зависимости от температуры (E o ), который откалиброван по критерию S при заданной температуре и учитывает влияние температуры на соотношение подачи кислорода к потребности рыбы. Минимальный МИ 2–5 указывает на способность окружающей среды снабжать кислородом в 2–5 раз быстрее, чем требуется для поддержания метаболических потребностей в состоянии покоя, и считается поддерживающим для населения. Это определило экваториальную границу распространения для разнообразной группы морских рыб и беспозвоночных (обзор в [17]).Измерение S crit и последующий расчет термочувствительного MI оказались полезными для прогнозирования пригодности среды обитания.
Северная популяция черного морского окуня ( Centropristis striata ) на NES США простирается от мыса Гаттерас до залива Мэн и сосредоточена в Срединно-Атлантическом заливе (MAB; [41]). Эти рыбы сезонно мигрируют с края континентального шельфа в более прохладные месяцы на прибрежные глубины (5-50 м) в теплые месяцы ([42,43]; рис. 1). Таким образом, сезонно мигрирующий черный морской окунь испытывает широкий диапазон температур в течение всего года, от 6°C зимой до 27°C в летние/ранние осенние месяцы [44].Хотя это средние сезонные температуры, в этом регионе наблюдаются большие межгодовые колебания температуры поверхности и дна [45,46]. Кроме того, при прогнозируемом удвоении антропогенного атмосферного содержания СО 2 в ближайшие 80 лет летняя придонная температура может достигать 30°С в южной части ареала черного морского окуня [6]. Это может потенциально ограничить южную прибрежную территорию обитания черного морского окуня. У побережья Нью-Джерси периодические явления гипоксии (например, концентрация O 2 < 2.2 мг л -1 при 14°C) может происходить летом в результате высокой биологической активности [47], подпитываемой апвеллингом богатых питательными веществами вод [48]. Таким образом, в теплые летние месяцы ограничение кислорода в гипоксических регионах вдоль NES США может также уменьшить метаболически доступную среду обитания для черного морского окуня.
1). Таким образом, сезонно мигрирующий черный морской окунь испытывает широкий диапазон температур в течение всего года, от 6°C зимой до 27°C в летние/ранние осенние месяцы [44].Хотя это средние сезонные температуры, в этом регионе наблюдаются большие межгодовые колебания температуры поверхности и дна [45,46]. Кроме того, при прогнозируемом удвоении антропогенного атмосферного содержания СО 2 в ближайшие 80 лет летняя придонная температура может достигать 30°С в южной части ареала черного морского окуня [6]. Это может потенциально ограничить южную прибрежную территорию обитания черного морского окуня. У побережья Нью-Джерси периодические явления гипоксии (например, концентрация O 2 < 2.2 мг л -1 при 14°C) может происходить летом в результате высокой биологической активности [47], подпитываемой апвеллингом богатых питательными веществами вод [48]. Таким образом, в теплые летние месяцы ограничение кислорода в гипоксических регионах вдоль NES США может также уменьшить метаболически доступную среду обитания для черного морского окуня.
Рис. 1. Сезонное распределение черного морского окуня по всему ареалу на северо-восточном шельфе США.
Распространение черного морского окуня показано как среднее значение CPUE пластов (1980–2017 гг.) по данным донной траловой съемки NOAA NMFS (Национальная служба морского рыболовства) (https://www.nefsc.noaa.gov/femad/ecosurvey/mainpage/). Цветные столбцы представляют среднее значение CPUE (прицеп кг -1 ), где более темные оттенки указывают на более высокое среднее значение CPUE. Осенняя съемка NMFS, обычно сентябрь-ноябрь (A; красный) и весна, обычно февраль-апрель (B; синий), распространение черного морского окуня показывает прибрежную и прибрежную среду обитания черного морского окуня соответственно. Зеленый квадрат = место сбора в 2016 г.; зеленый круг = место сбора в 2017 году.
https://doi.org/10.1371/journal.pone.0218390.g001
Северная популяция черного морского окуня, возможно, уже демонстрирует смещение к полюсу, вероятно, из-за потепления океана [7,49]. Доказательства текущих сдвигов в распределении черного морского окуня получены в основном из данных донной траловой съемки [7]. Лабораторные исследования процессов, сосредоточенные на физиологии организма, позволяют детально изучить механистические отношения между окружающей средой и животным [50]. Результаты этих физиологических исследований полезны для моделирования метаболически подходящей среды обитания на основе параметров окружающей среды [51] и могут быть использованы для моделирования современного распределения черного морского окуня (например,g., [17,52]) и спрогнозировать будущие сдвиги в распределении при продолжающемся потеплении океана.
Доказательства текущих сдвигов в распределении черного морского окуня получены в основном из данных донной траловой съемки [7]. Лабораторные исследования процессов, сосредоточенные на физиологии организма, позволяют детально изучить механистические отношения между окружающей средой и животным [50]. Результаты этих физиологических исследований полезны для моделирования метаболически подходящей среды обитания на основе параметров окружающей среды [51] и могут быть использованы для моделирования современного распределения черного морского окуня (например,g., [17,52]) и спрогнозировать будущие сдвиги в распределении при продолжающемся потеплении океана.
Это исследование преследовало три цели. Во-первых, мы измерили AAS и S crit (для расчета MI) для северной популяции взрослого черного морского окуня в диапазоне температур, наблюдаемых на берегу, чтобы сравнить, если они есть, температурные оптимумы. Эти параметры потенциально могут быть использованы в будущем для моделирования пригодности местообитаний и оценки будущих изменений в распределении черного морского окуня. Во-вторых, мы проверили способность черного морского окуня акклиматизироваться к экстремально высокой температуре (30 ° C), учитывая высокую вероятность того, что такие температуры станут более распространенными в прогнозах изменения климата в будущем.Подгруппа черного морского окуня была акклиматизирована к 30°C в течение одного месяца, и их аэробные характеристики сравнивались с теми рыбами, которые тестировались в условиях краткосрочной акклиматизации. И, наконец, мы сравнили два разных метода измерения MMR, метод погони и метод плавания, чтобы выяснить, какой метод лучше работает для черного морского окуня.
Во-вторых, мы проверили способность черного морского окуня акклиматизироваться к экстремально высокой температуре (30 ° C), учитывая высокую вероятность того, что такие температуры станут более распространенными в прогнозах изменения климата в будущем.Подгруппа черного морского окуня была акклиматизирована к 30°C в течение одного месяца, и их аэробные характеристики сравнивались с теми рыбами, которые тестировались в условиях краткосрочной акклиматизации. И, наконец, мы сравнили два разных метода измерения MMR, метод погони и метод плавания, чтобы выяснить, какой метод лучше работает для черного морского окуня.
Материалы и методы
Сбор и разведение рыбы
Взрослый черный морской окунь ( Centropristis striata ) из северной стаи (длина = 221-398 мм, вес = 193.7–700,4 г) были собраны у побережья штата Нью-Джерси, США, на глубинах 15–20 м в начале июня с рифа Си Гирт (40°7’07” с.ш., 73°58’42” з.д.) ловушками (июнь 14–21 2016 г.), а также с местных рифов у Сэнди-Хук (40°28’46” с. ш., 73°57’47” з.д.) на крючки (28 июня – 5 июля 2017 г.). После отлова рыбу помещали в Морскую лабораторию NOAA имени Джеймса Дж. Ховарда при температуре окружающей среды (22 ± 1 °C) и солености (26 ppt) при естественном фотопериоде для лета в Нью-Джерси (14 часов: 10 часов свет: темнота). , и кормили ежедневно до насыщения диетой из песчанки и атерины на время экспериментов по респирометрии.Температуру и соленость воды контролировали ежедневно с помощью YSI (Pro-30; Йеллоу-Спрингс, Огайо, США), а химический состав воды оставался на приемлемом уровне (нитраты < 20 мкМ, нитриты не обнаруживаются, аммиак <0,05 мкМ, диапазон pH 7,98–8,04). ). Рыб акклиматизировали к условиям содержания в неволе как минимум за две недели до испытаний, после чего все подопытные рыбы регулярно питались и находились в хорошем состоянии. Время от сбора рыбы до экспериментальных испытаний составляло от двух до четырех недель. После акклиматизации у рыб измеряли длину (TL мм), вес (г) и метили индивидуально пронумерованными Т-образными бирками Floy, вставленными под спинные лучи.
ш., 73°57’47” з.д.) на крючки (28 июня – 5 июля 2017 г.). После отлова рыбу помещали в Морскую лабораторию NOAA имени Джеймса Дж. Ховарда при температуре окружающей среды (22 ± 1 °C) и солености (26 ppt) при естественном фотопериоде для лета в Нью-Джерси (14 часов: 10 часов свет: темнота). , и кормили ежедневно до насыщения диетой из песчанки и атерины на время экспериментов по респирометрии.Температуру и соленость воды контролировали ежедневно с помощью YSI (Pro-30; Йеллоу-Спрингс, Огайо, США), а химический состав воды оставался на приемлемом уровне (нитраты < 20 мкМ, нитриты не обнаруживаются, аммиак <0,05 мкМ, диапазон pH 7,98–8,04). ). Рыб акклиматизировали к условиям содержания в неволе как минимум за две недели до испытаний, после чего все подопытные рыбы регулярно питались и находились в хорошем состоянии. Время от сбора рыбы до экспериментальных испытаний составляло от двух до четырех недель. После акклиматизации у рыб измеряли длину (TL мм), вес (г) и метили индивидуально пронумерованными Т-образными бирками Floy, вставленными под спинные лучи. Для каждой температурной обработки рыбу акклиматизировали со скоростью 2°C в день -1 до достижения экспериментальной температуры, а затем выдерживали при заданной температуре обработки не менее 48 часов до начала экспериментов. Мы определили это и ссылаемся на этот процесс как на краткосрочную акклиматизацию. Рыб голодали за 48 ч до начала каждого эксперимента для устранения последствий специфического динамического воздействия [53]. Всего в 2016 и 2017 гг. было использовано 152 экспериментальных рыбы (набор данных S1).
Для каждой температурной обработки рыбу акклиматизировали со скоростью 2°C в день -1 до достижения экспериментальной температуры, а затем выдерживали при заданной температуре обработки не менее 48 часов до начала экспериментов. Мы определили это и ссылаемся на этот процесс как на краткосрочную акклиматизацию. Рыб голодали за 48 ч до начала каждого эксперимента для устранения последствий специфического динамического воздействия [53]. Всего в 2016 и 2017 гг. было использовано 152 экспериментальных рыбы (набор данных S1).
Экспериментальная установка
Экспериментальные резервуары (1200 л) были заполнены обработанной морской водой из залива Сэнди-Хук, которая непрерывно циркулировала по замкнутой системе. Циркуляционная морская вода была обработана с помощью фильтров (песочных и биологических) и ультрафиолетового излучения, а соленость была отрегулирована так, чтобы имитировать средние летние значения придонной воды на берегу Нью-Джерси (32 ± 1 ppt). Экспериментальные температуры были достигнуты с использованием встроенных чиллеров (Aqua Logic Delta Star; Сан-Диего, Калифорния, США) и/или нагревателей с титановым теплообменником (Innovative Heat Concepts, Homestead, Флорида, США) и поддерживались на уровне ±1°C от заданной температуры. .
.
Скорость метаболизма измеряли с помощью прерывистой респирометрии в соответствии с протоколами, изложенными в Clark et al. [54] и Свендсен и соавт. [55]. Проточные респирометры (13,5 л; оргстекло 23 [В] x 26 [Ш] x 37 [Д] см) помещали в два экспериментальных резервуара (два респирометра на резервуар; четыре респирометра на испытание). Промывочные насосы (Eheim Universal 600 л/ч; Дейзизау, Германия), подключенные к респирометру, использовались для забора воды из термостата окружающей среды для пополнения растворенного кислорода и устранения накопления метаболических отходов внутри респирометра.Продолжительность и время промывок устанавливали прерывистые циклы, которые контролировались в течение заданной временной последовательности с использованием прибора DAQ-M (Loligo Systems; Выборг, Дания) и определялись на основе температуры испытания, так что % O 2 насыщение воздухом (%O 2 ) оставалось выше 75% [56]. См. таблицу S1 для списка прерывистых промывок при каждой температуре. Для каждого закрытого периода измерения (когда промывочные насосы были выключены) скорость снижения концентрации растворенного кислорода в герметичном респирометре использовалась для расчета массовой удельной скорости потребления кислорода, косвенного показателя скорости метаболизма.Замкнутый контур рециркуляции, соединенный с насосом меньшего размера (Eheim Universal 300 л/ч; Дейзизау, Германия), также использовался для равномерного распределения растворенного кислорода внутри респирометра и обеспечения потока воды через оптический мини-датчик погружного датчика кислорода (PreSens Pst3; Регенсбург, Германия). ). Кислородные зонды были откалиброваны в соответствии с руководством поставщика (погружной кислородный зонд PSt3, PreSens GmbH, Регенсбург, Германия) и проверены с помощью YSI (ProSolo ODO; Йеллоу-Спрингс, Огайо, США), который был откалиброван в 100 и 0% O 2 проб воды.Компьютерное программное обеспечение Autoresp (Loligo Systems; Выборг, Дания) и прибор Witrox-4 (Loligo Systems; Выборг, Дания) использовали для непрерывного мониторинга растворенного кислорода и температуры внутри респирометра в ходе эксперимента.
Для каждого закрытого периода измерения (когда промывочные насосы были выключены) скорость снижения концентрации растворенного кислорода в герметичном респирометре использовалась для расчета массовой удельной скорости потребления кислорода, косвенного показателя скорости метаболизма.Замкнутый контур рециркуляции, соединенный с насосом меньшего размера (Eheim Universal 300 л/ч; Дейзизау, Германия), также использовался для равномерного распределения растворенного кислорода внутри респирометра и обеспечения потока воды через оптический мини-датчик погружного датчика кислорода (PreSens Pst3; Регенсбург, Германия). ). Кислородные зонды были откалиброваны в соответствии с руководством поставщика (погружной кислородный зонд PSt3, PreSens GmbH, Регенсбург, Германия) и проверены с помощью YSI (ProSolo ODO; Йеллоу-Спрингс, Огайо, США), который был откалиброван в 100 и 0% O 2 проб воды.Компьютерное программное обеспечение Autoresp (Loligo Systems; Выборг, Дания) и прибор Witrox-4 (Loligo Systems; Выборг, Дания) использовали для непрерывного мониторинга растворенного кислорода и температуры внутри респирометра в ходе эксперимента.
Прерывистая респирометрия также использовалась в экспериментах с гипоксией для контроля CO 2 и накопления метаболитов в респирометре [57]. В этой установке каждый промывочный насос респирометра был подключен к отдельному внешнему резервуару для воды, содержащему одну и ту же системную воду.Во внешнем резервуаре для воды использовался насос (Eheim Universal 1200 л/ч; Deizisau, Германия) для обеспечения равномерного перемешивания и подачи потока через кислородный оптод для контроля источника %O 2 , который служил в качестве перемешивающего устройства. Четыре небольших микродиффузора были соединены с газовым баллоном N 2 [37] и использовались для диффузии газообразного азота и последующего перемещения O 2 во внешней ванне. N 2 был выпущен вручную с помощью регулятора продувки азотом (Randor SR5B-580 Airgas; Париж, Франция), позволяющего контролировать PSI внутри канистры и выпускаемого во внешний резервуар для воды. Для тонкой настройки %O 2 во внешней водяной бане системная вода периодически закачивалась во внешний резервуар и использовалась для пополнения запасов воды. Все изменения уровней %O 2 производились в период закрытого измерения, когда экспериментальные респирометры были закрыты для внешнего потока воды, чтобы избежать колебаний уровня %O 2 в отдельных респирометрах.
Для тонкой настройки %O 2 во внешней водяной бане системная вода периодически закачивалась во внешний резервуар и использовалась для пополнения запасов воды. Все изменения уровней %O 2 производились в период закрытого измерения, когда экспериментальные респирометры были закрыты для внешнего потока воды, чтобы избежать колебаний уровня %O 2 в отдельных респирометрах.
Эксперименты проводились в диапазоне температур (12, 17, 22, 24, 27 и 30°С).Для экспериментов 2016 и 2017 годов мы провели кратковременную акклиматизацию черного морского окуня перед началом каждого аэробного испытания ( см. Сбор и разведение рыбы) . В дополнение к краткосрочным испытаниям на акклиматизацию при каждой температуре мы также включили температурную обработку с хроническим воздействием (один месяц) до 30 °C (30 хронических °C), поскольку прогнозы потепления океана в следующем столетии предсказывают летние придонные температуры. достигает 30°С в южной части ареала черного морского окуня [6]. Это позволило протестировать текущий потенциал акклиматизации черного морского окуня, оценив влияние длительного воздействия температуры 30°C на аэробную активность и толерантность к гипоксии. Размеры образцов для всех температурных обработок указаны в наборе данных S1.
Это позволило протестировать текущий потенциал акклиматизации черного морского окуня, оценив влияние длительного воздействия температуры 30°C на аэробную активность и толерантность к гипоксии. Размеры образцов для всех температурных обработок указаны в наборе данных S1.
Мы использовали два разных метода, пытаясь выявить максимальную скорость метаболизма (MMR): исчерпывающую погоню и плавательный лоток. MMR был протестирован с использованием двух разных методов, поскольку используемый метод может повлиять на результирующую скорость метаболизма и, следовательно, на ААС [23–24,58]. Поэтому было проведено сравнение ААС, полученных методами «погони» и «плавательного лотка».Для метода погони особи черного морского окуня помещались в резервуар для погони диаметром 4 фута, наполненный водой из экспериментальных резервуаров. Рыбу доводили до изнеможения с помощью тактильной стимуляции хвостового плавника. Истощение определяли как момент, когда рыба переставала реагировать на дальнейшую тактильную стимуляцию и воздействие воздуха. Затем рыбу немедленно переносили и запечатывали в индивидуальных респирометрах в течение ~ 1 минуты после окончания погони. Рыба оставалась в респирометрах в течение ~ 23 часов, что позволяло восстановиться и последующее измерение стандартной скорости метаболизма (SMR) [59].При каждой температурной обработке использовали шестнадцать рыб. При обработке при 30 хронической температуре °C размер выборки составил девять рыб из-за удаления пяти рыб в плохом состоянии до и двух рыб во время экспериментов. В конце измерений SMR первые двенадцать рыб отдыхали не менее 24 часов, а затем тренировались в плавательном лотке. Последние четыре рыбы каждой температурной обработки оставались в респирометре для тестирования на гипоксию (см. ниже). Для плавательного лотка отдельные рыбы тренировались в акриловом респирометре Бретта (Loligo Systems 90L; Выборг, Дания).Рыбу помещали в рабочую часть лотка (20[В] x 20[Ш] x 70[Д] см) и герметизировали в лотке на время эксперимента. Пропеллер с приводом от двигателя, расположенный внутри желоба и отдельно от рабочей секции, использовался как для ручного изменения скорости, чтобы обеспечить измерения на разных уровнях активности, так и для непрерывного равномерного перемешивания воды (и O 2 ) по всей камере.
Затем рыбу немедленно переносили и запечатывали в индивидуальных респирометрах в течение ~ 1 минуты после окончания погони. Рыба оставалась в респирометрах в течение ~ 23 часов, что позволяло восстановиться и последующее измерение стандартной скорости метаболизма (SMR) [59].При каждой температурной обработке использовали шестнадцать рыб. При обработке при 30 хронической температуре °C размер выборки составил девять рыб из-за удаления пяти рыб в плохом состоянии до и двух рыб во время экспериментов. В конце измерений SMR первые двенадцать рыб отдыхали не менее 24 часов, а затем тренировались в плавательном лотке. Последние четыре рыбы каждой температурной обработки оставались в респирометре для тестирования на гипоксию (см. ниже). Для плавательного лотка отдельные рыбы тренировались в акриловом респирометре Бретта (Loligo Systems 90L; Выборг, Дания).Рыбу помещали в рабочую часть лотка (20[В] x 20[Ш] x 70[Д] см) и герметизировали в лотке на время эксперимента. Пропеллер с приводом от двигателя, расположенный внутри желоба и отдельно от рабочей секции, использовался как для ручного изменения скорости, чтобы обеспечить измерения на разных уровнях активности, так и для непрерывного равномерного перемешивания воды (и O 2 ) по всей камере. Лоток был полностью погружен во внешнюю водяную баню (71 [В] x 35 [Ш] x 188 [Д] см) для поддержания постоянной температуры на протяжении всего испытания.Насос (Eheim Universal 1200 л/ч; Deizisau, Германия) использовался для прерывистой промывки новой системной воды в лотковую камеру после периодов измерения и для подачи системной воды во внешнюю ванну во время периодов измерения. Рыбу тренировали по спринтерскому протоколу. Сначала рыбе давали возможность адаптироваться к плавательному желобу в течение 10 минут при минимальном потоке, чтобы обеспечить перемешивание. Затем поток медленно увеличили до скорости плавания 0,95 BL s -1 , черный морской окунь начал плавать с самой низкой скоростью в течение пятиминутного периода.Рыба адаптировалась к этой скорости примерно за 10 минут. После периода адаптации скорость постепенно увеличивалась в течение пяти минут до тех пор, пока рыба не начинала бежать (обозначается как > 10 рывков с использованием хвостового плавника в течение 30-секундных интервалов и неспособность сохранять положение в рабочей секции без рывкового плавания).
Лоток был полностью погружен во внешнюю водяную баню (71 [В] x 35 [Ш] x 188 [Д] см) для поддержания постоянной температуры на протяжении всего испытания.Насос (Eheim Universal 1200 л/ч; Deizisau, Германия) использовался для прерывистой промывки новой системной воды в лотковую камеру после периодов измерения и для подачи системной воды во внешнюю ванну во время периодов измерения. Рыбу тренировали по спринтерскому протоколу. Сначала рыбе давали возможность адаптироваться к плавательному желобу в течение 10 минут при минимальном потоке, чтобы обеспечить перемешивание. Затем поток медленно увеличили до скорости плавания 0,95 BL s -1 , черный морской окунь начал плавать с самой низкой скоростью в течение пятиминутного периода.Рыба адаптировалась к этой скорости примерно за 10 минут. После периода адаптации скорость постепенно увеличивалась в течение пяти минут до тех пор, пока рыба не начинала бежать (обозначается как > 10 рывков с использованием хвостового плавника в течение 30-секундных интервалов и неспособность сохранять положение в рабочей секции без рывкового плавания). Как только рыба достигает своей скорости бега, промывочный насос выключают, а желоб закрывают, чтобы можно было измерить скорость метаболизма. Рыбу удерживали на скорости бега в течение 10 минут или до отказа, определяемого, когда рыба отдыхала у задней решетки более 10 секунд.
Как только рыба достигает своей скорости бега, промывочный насос выключают, а желоб закрывают, чтобы можно было измерить скорость метаболизма. Рыбу удерживали на скорости бега в течение 10 минут или до отказа, определяемого, когда рыба отдыхала у задней решетки более 10 секунд.
Фоновое дыхание измеряли, измеряя фон MO 2 (MO 2br ) до и после испытания в пустых респирометрах в течение ~1,5 часа. Линейная регрессия между МО 2br до и после МО использовалась для применения поправочного коэффициента к каждому значению МО 2 , зарегистрированному на протяжении всего эксперимента.
Критический %O
2 определений Эксперименты Hypoxia (S crit ) были проведены на последних четырех рыбах каждого испытания температурной обработки.Это позволило надежно использовать рыбу, которая уже акклиматизировалась к респирометрам и достигла SMR за одну ночь. S crit измеряли путем постепенного уменьшения %O 2 в респирометрах [37]. Мы измерили ~10%O 2 бинов. Количество бункеров зависело от температуры в зависимости от того, где произошел S crit . Эксперимент начинался при 100%O 2 и постепенно снижался на 10%O 2 (100, 90, 80, 70% и т. д.) до тех пор, пока S крит не был надежно достигнут, на что указывает значительное снижение скорости метаболизма. и отклонение в SMR.Следовательно, по мере снижения толерантности к гипоксии при более высоких температурах количество бинов %O 2 в эксперименте также уменьшалось. В каждом бункере %O 2 было измерено три прерывистых цикла (промывка, ожидание, измерение), которые в совокупности длились ~ 30 минут в зависимости от температуры. Если рыба теряла равновесие или показывала признаки бедствия, эксперимент для этой особи немедленно прекращался.
Мы измерили ~10%O 2 бинов. Количество бункеров зависело от температуры в зависимости от того, где произошел S crit . Эксперимент начинался при 100%O 2 и постепенно снижался на 10%O 2 (100, 90, 80, 70% и т. д.) до тех пор, пока S крит не был надежно достигнут, на что указывает значительное снижение скорости метаболизма. и отклонение в SMR.Следовательно, по мере снижения толерантности к гипоксии при более высоких температурах количество бинов %O 2 в эксперименте также уменьшалось. В каждом бункере %O 2 было измерено три прерывистых цикла (промывка, ожидание, измерение), которые в совокупности длились ~ 30 минут в зависимости от температуры. Если рыба теряла равновесие или показывала признаки бедствия, эксперимент для этой особи немедленно прекращался.
Заявление об этике
Разведение и эксперименты проводились в соответствии с соответствующими национальными и международными рекомендациями. Рыба была собрана в соответствии с разрешениями № 1610 и № 1717, выданными Департаментом охраны окружающей среды Нью-Джерси. Исчезающие или охраняемые виды не были задействованы. Протоколы лечения и процедуры эвтаназии всех животных, о которых здесь сообщается, были одобрены протоколом № 15–054 Комитета по институциональному уходу и использованию животных Университета Рутгерса. Были приложены все усилия, чтобы обеспечить минимальную боль и страдания. За поведением, кормлением и состоянием рыб следили ежедневно. Любая рыба с явными проблемами со здоровьем или чрезмерным стрессом (т.е. отсутствие аппетита, трудности с плавучестью или ориентацией) в опытах не использовались. Рыбу, у которой не было очевидных проблем со здоровьем и которая демонстрировала сильный стресс, усыпляли с помощью передозировки MS-222 (250 мг/л -1 ). В период с 2016 по 2017 год для экспериментов использовали 152 из 164 рыб. Десять рыб были в плохом состоянии, а две рыбы продолжали испытывать симптомы баротравмы (т.
Рыба была собрана в соответствии с разрешениями № 1610 и № 1717, выданными Департаментом охраны окружающей среды Нью-Джерси. Исчезающие или охраняемые виды не были задействованы. Протоколы лечения и процедуры эвтаназии всех животных, о которых здесь сообщается, были одобрены протоколом № 15–054 Комитета по институциональному уходу и использованию животных Университета Рутгерса. Были приложены все усилия, чтобы обеспечить минимальную боль и страдания. За поведением, кормлением и состоянием рыб следили ежедневно. Любая рыба с явными проблемами со здоровьем или чрезмерным стрессом (т.е. отсутствие аппетита, трудности с плавучестью или ориентацией) в опытах не использовались. Рыбу, у которой не было очевидных проблем со здоровьем и которая демонстрировала сильный стресс, усыпляли с помощью передозировки MS-222 (250 мг/л -1 ). В период с 2016 по 2017 год для экспериментов использовали 152 из 164 рыб. Десять рыб были в плохом состоянии, а две рыбы продолжали испытывать симптомы баротравмы (т. е. экзофтальм) до экспериментов и не использовались. Три рыбы проявили признаки бедствия во время эксперимента и были немедленно удалены и взяты под наблюдение.Когда состояние не улучшалось, рыбу усыпляли. Все эти летальные исходы были связаны с 30 хроническими обработками при температуре °C и 30 °C. Все подопытные животные были подвергнуты эвтаназии в конце эксперимента с MS-222 (250 мг/л -1 ) для определения пола рыбы и предотвращения любого возможного распространения патогенов или инфекционных заболеваний в естественных популяциях, которые могли возникнуть в результате длительное пленение в лаборатории (~ 2 месяца) и осталось незамеченным.
е. экзофтальм) до экспериментов и не использовались. Три рыбы проявили признаки бедствия во время эксперимента и были немедленно удалены и взяты под наблюдение.Когда состояние не улучшалось, рыбу усыпляли. Все эти летальные исходы были связаны с 30 хроническими обработками при температуре °C и 30 °C. Все подопытные животные были подвергнуты эвтаназии в конце эксперимента с MS-222 (250 мг/л -1 ) для определения пола рыбы и предотвращения любого возможного распространения патогенов или инфекционных заболеваний в естественных популяциях, которые могли возникнуть в результате длительное пленение в лаборатории (~ 2 месяца) и осталось незамеченным.
Анализ данных
Рыба MO 2 представлена как удельная по массе (MO 2 : mgO 2 кг -1 ч -1 ) и рассчитана по наклону снижения насыщения кислородом в течение каждого периода закрытого измерения с использованием уравнение: где MO 2 — удельная скорость метаболизма (в мгО 2 кг -1 ч -1 ), [O 2 ] t0 — концентрация кислорода (мгО 2 /л) при время t = 0, [O 2 ] t1 — концентрация кислорода в момент времени t = 1, V — объем респирометра (л) без объема рыбы, t — t 1 -t 0 (ч ) относится к одному периоду измерения, а BW – масса тела (кг) рыбы. MO 2 автоматически рассчитывался после каждого периода измерения в программе AutoResp в ходе эксперимента. Этот расчет был использован как для измерений MO 2 в респирометрах, так и в плавательном лотке. Проверка каждого значения MO 2 проводилась с использованием значений R 2 для каждого периода измерений. Измерения MO 2 со значениями R 2 <0,9 не использовались.
MO 2 автоматически рассчитывался после каждого периода измерения в программе AutoResp в ходе эксперимента. Этот расчет был использован как для измерений MO 2 в респирометрах, так и в плавательном лотке. Проверка каждого значения MO 2 проводилась с использованием значений R 2 для каждого периода измерений. Измерения MO 2 со значениями R 2 <0,9 не использовались.
Стандартная скорость метаболизма была рассчитана на основе усеченного набора данных, за исключением часов повышенных значений MO 2 после тренировки, и с использованием квантиля 20 th данных SMR в пакете calcSMR в R [59].SMR всех рыб измеряли в течение не менее 15 часов в усеченных наборах данных. Вкратце, было создано частотное распределение значений MO 2 из усеченного набора данных, и значение в квантиле 20 th было взято как SMR. Использование квантиля 20 th по сравнению с другими методами (т. е. самые низкие 10%, среднее из 10 самых низких значений) предпочтительнее, потому что значения MO 2 естественным образом колеблются выше и ниже SMR и позволяют избежать потенциальной недооценки SMR [59]. MMR в протоколах погони и плавания определялся как самый высокий показатель MO 2 , зарегистрированный во время соответствующих испытаний.Различие между методами MMR было проанализировано с использованием двухвыборочного теста Welch t , поскольку размеры выборок были неравными. Аэробный объем рассчитывался с использованием обоих методов MMR в абсолютном выражении (AAS = MMR-SMR) и в факторном выражении (FAS = MMR/SMR). В 2016 году тестирование рыбы было ограничено тремя температурами (24, 27 и 30 °C) из-за трудностей с поддержанием температуры, а некоторые особи были протестированы более чем при одной температуре из-за ограниченного количества рыбы, полученной для тестирования. Только рыба, которая использовалась один раз, в конечном итоге была включена в анализ данных 2016 года для обеспечения независимости данных.
е. самые низкие 10%, среднее из 10 самых низких значений) предпочтительнее, потому что значения MO 2 естественным образом колеблются выше и ниже SMR и позволяют избежать потенциальной недооценки SMR [59]. MMR в протоколах погони и плавания определялся как самый высокий показатель MO 2 , зарегистрированный во время соответствующих испытаний.Различие между методами MMR было проанализировано с использованием двухвыборочного теста Welch t , поскольку размеры выборок были неравными. Аэробный объем рассчитывался с использованием обоих методов MMR в абсолютном выражении (AAS = MMR-SMR) и в факторном выражении (FAS = MMR/SMR). В 2016 году тестирование рыбы было ограничено тремя температурами (24, 27 и 30 °C) из-за трудностей с поддержанием температуры, а некоторые особи были протестированы более чем при одной температуре из-за ограниченного количества рыбы, полученной для тестирования. Только рыба, которая использовалась один раз, в конечном итоге была включена в анализ данных 2016 года для обеспечения независимости данных. Было значительное влияние массы на MO 2 (F 1,117 = 4,651; P <0,05; рис. 2). Таким образом, влияние температуры на MO 2 было проанализировано с использованием однофакторного ANCOVA с весом в качестве ковариации. Апостериорный тест Тьюки HSD использовался для определения значимых парных сравнений между температурами. MO 2 был скорректирован на средний вес рыбы (346,9 г) с использованием оценочных предельных средних из ANCOVA. Расчетные предельные средние значения обеспечивают среднее значение MO 2 (MO 2adj ) с поправкой на вес и стандартную ошибку для каждой температурной обработки.Эти значения использовались для сообщения результатов и на графиках, где вес оказывал значительное влияние на MO 2 . Кривые для аэробных условий были смоделированы с использованием полиномиальной аппроксимации 3 rd градусов и использовались для оценки теплового оптимума (температура при самом высоком AS).
Было значительное влияние массы на MO 2 (F 1,117 = 4,651; P <0,05; рис. 2). Таким образом, влияние температуры на MO 2 было проанализировано с использованием однофакторного ANCOVA с весом в качестве ковариации. Апостериорный тест Тьюки HSD использовался для определения значимых парных сравнений между температурами. MO 2 был скорректирован на средний вес рыбы (346,9 г) с использованием оценочных предельных средних из ANCOVA. Расчетные предельные средние значения обеспечивают среднее значение MO 2 (MO 2adj ) с поправкой на вес и стандартную ошибку для каждой температурной обработки.Эти значения использовались для сообщения результатов и на графиках, где вес оказывал значительное влияние на MO 2 . Кривые для аэробных условий были смоделированы с использованием полиномиальной аппроксимации 3 rd градусов и использовались для оценки теплового оптимума (температура при самом высоком AS).
Рис. 2. Температура и масса тела влияют на стандартную скорость метаболизма черного морского окуня.
SMR (n = 121) для каждой температурной обработки нанесен на график в зависимости от массы тела (г). Подогнанная линия регрессии показывает, что помимо влияния температуры на SMR также влияет масса тела ( P <0.05). 30c = 30 хроническая обработка при °C.
https://doi.org/10.1371/journal.pone.0218390.g002
Q 10 значения были рассчитаны для MO 2adj между приращениями температуры и между диапазоном температур по формуле: где Q 10 — температурный коэффициент для МО 2 , R 1 — МО 2 при Т 1 и R 2 — МО 2 8 907 9068 при Т 2 .
S crit был определен с использованием регрессии ломаной палочки, которая соответствует двум линиям регрессии через данные: одна через область, где МО 2 оставалась стабильной при снижении %O 2 , и одна через часть, где МО 2 уменьшалась линейно с уменьшением %O 2 . Пересечение двух линий регрессии является критической точкой, используемой для S crit [60]. Это было проанализировано с использованием кода R в пакете calcO2crit из [40].Поскольку у нас был размер выборки из четырех рыб на температурную обработку, был проведен анализ мощности для определения статистической мощности этого небольшого размера выборки. Влияние веса на S crit было незначительным ( P> 0,05), поэтому для оценки влияния температуры на S crit использовали однофакторный дисперсионный анализ, а апостериорный тест Тьюки HSD применяли для определить значимые попарные сравнения между температурами. Метаболический индекс (МИ) рассчитывали по уравнению из [17]: где φ — индекс метаболизма, A O O — соотношение коэффициентов скорости, B N — масштабирование массы тела, PO 2 — Ambient O 2 давление, E o – зависимость базовой скорости метаболизма от температуры, k B – постоянная Больцмана, T – температура.
Пересечение двух линий регрессии является критической точкой, используемой для S crit [60]. Это было проанализировано с использованием кода R в пакете calcO2crit из [40].Поскольку у нас был размер выборки из четырех рыб на температурную обработку, был проведен анализ мощности для определения статистической мощности этого небольшого размера выборки. Влияние веса на S crit было незначительным ( P> 0,05), поэтому для оценки влияния температуры на S crit использовали однофакторный дисперсионный анализ, а апостериорный тест Тьюки HSD применяли для определить значимые попарные сравнения между температурами. Метаболический индекс (МИ) рассчитывали по уравнению из [17]: где φ — индекс метаболизма, A O O — соотношение коэффициентов скорости, B N — масштабирование массы тела, PO 2 — Ambient O 2 давление, E o – зависимость базовой скорости метаболизма от температуры, k B – постоянная Больцмана, T – температура. Здесь данные S crit для каждой температурной обработки используются для определения параметров уравнения.
Здесь данные S crit для каждой температурной обработки используются для определения параметров уравнения.
Все статистические анализы были выполнены в R 3.4.3 [61]. Данные были проверены на предмет предположения о нормальности с помощью графика визуальной нормы Q-Q и статистически с помощью теста Шапиро-Уилка, где P > 0,05 указывают на нормально распределенные данные. Однородность оценивали с помощью теста Левена, где P > 0.05 указывает на однородность. Данные, которые не соответствовали предположениям о нормальности, были логарифмически преобразованы перед дальнейшим статистическим анализом. Данные представлены как среднее ± SE, а результаты статистического анализа определены как значимые при P <0,05.
Результаты
Скорость метаболизма и аэробный объем
SMR значительно увеличивался с температурой (рис. 2A и 2B), и на SMR оказывалось значительное влияние веса и взаимодействия температура*масса ( P < 0. 05; Таблица 1). Значения SMR, полученные из квантиля 20 th , находились в пределах одного стандартного отклонения от среднего значения усеченного набора данных для каждой рыбы. В то время как результаты для двух методов MMR значительно различались ( P < 0,05 для всех температур), взаимодействие температуры, веса и температуры * веса оказывало значительное влияние на MMR при использовании любого метода ( P < 0,05; Таблица 1). MMR преследования непрерывно увеличивался с температурой, в то время как MMR плавательного лотка увеличивался с температурой до ~ 27 ° C (рис. 3A и 3B).Значения MMR от плавательного лотка были постоянно выше во всем диапазоне температур, чем при методе погони, что указывает на то, что скорость метаболизма, достигнутая во время погони, вероятно, не была максимально возможной для этого вида.
05; Таблица 1). Значения SMR, полученные из квантиля 20 th , находились в пределах одного стандартного отклонения от среднего значения усеченного набора данных для каждой рыбы. В то время как результаты для двух методов MMR значительно различались ( P < 0,05 для всех температур), взаимодействие температуры, веса и температуры * веса оказывало значительное влияние на MMR при использовании любого метода ( P < 0,05; Таблица 1). MMR преследования непрерывно увеличивался с температурой, в то время как MMR плавательного лотка увеличивался с температурой до ~ 27 ° C (рис. 3A и 3B).Значения MMR от плавательного лотка были постоянно выше во всем диапазоне температур, чем при методе погони, что указывает на то, что скорость метаболизма, достигнутая во время погони, вероятно, не была максимально возможной для этого вида.
Рис. 3.
Влияние температуры на стандартную скорость метаболизма и максимальную скорость метаболизма, измеренную с помощью метода погони и плавательного лотка. MMR (закрашенные кружки) и SMR (незаштрихованные кружки) представлены как среднее значение ± стандартная ошибка. нормированный к среднему весу 346.9 г для каждой температурной обработки для метода чейза MMR (A) и метода MMR с плавательным лотком (B). SMR немного отличается между (A) и (B) в зависимости от того, какая рыба использовалась для соответствующего метода MMR. Группа 30 хронических °C обозначена треугольниками. Значение Tukey post hoc между видами лечения показано буквами, где точки данных с разными буквами указывают на значимое различие ( P <0,05).
MMR (закрашенные кружки) и SMR (незаштрихованные кружки) представлены как среднее значение ± стандартная ошибка. нормированный к среднему весу 346.9 г для каждой температурной обработки для метода чейза MMR (A) и метода MMR с плавательным лотком (B). SMR немного отличается между (A) и (B) в зависимости от того, какая рыба использовалась для соответствующего метода MMR. Группа 30 хронических °C обозначена треугольниками. Значение Tukey post hoc между видами лечения показано буквами, где точки данных с разными буквами указывают на значимое различие ( P <0,05).
https://doi.org/10.1371/журнал.pone.0218390.g003
Несмотря на то, что метод чейза не позволяет достичь MMR, он все же обеспечивает оценку субмаксимальной физической работоспособности в диапазоне температур. MMR, достигнутый с использованием метода Чейза, непрерывно увеличивался с температурой и достиг максимального скорректированного значения 396,65 ± 11,48 мг O 2 кг -1 ч -1 при 30,0 °C (самая высокая измеренная температура; таблица 2; рис. 3А). MMR, измеренный с использованием плавательного лотка, достиг максимума 497,96 ± 21,92 мг O 2 кг -1 ч -1 при 27°C (таблица 2; рис. 3B).AAS с использованием метода плавательного лотка достигла максимума, обычно обозначаемого как «T opt », при ~ 24,4 ° C (рис. 3B). Было выявлено значительное влияние температуры, веса и взаимодействия температура*масса на ААС ( P <0,05), рассчитанное отдельно по обоим методам MMR (таблица 1). Использование различных методов MMR привело к различиям в форме кривой AAS (рис. 4A и 4B) и предполагаемому тепловому оптимуму с последствиями для его интерпретации. Обработка при 24°C была немного завышена и имела большую стандартную ошибку для AAS и MMR при нормализации к среднему весу рыбы 346.9 г, потому что средний вес рыбы при этой температурной обработке составлял 253,9 г (см. рис. S1 для нормированного веса при каждой температуре). Однако при обработке при температуре 24 °C использовался только метод Чейза, который, как мы определили, не дает точной оценки MMR, и поэтому эта завышенная оценка не влияет на наши выводы.
3А). MMR, измеренный с использованием плавательного лотка, достиг максимума 497,96 ± 21,92 мг O 2 кг -1 ч -1 при 27°C (таблица 2; рис. 3B).AAS с использованием метода плавательного лотка достигла максимума, обычно обозначаемого как «T opt », при ~ 24,4 ° C (рис. 3B). Было выявлено значительное влияние температуры, веса и взаимодействия температура*масса на ААС ( P <0,05), рассчитанное отдельно по обоим методам MMR (таблица 1). Использование различных методов MMR привело к различиям в форме кривой AAS (рис. 4A и 4B) и предполагаемому тепловому оптимуму с последствиями для его интерпретации. Обработка при 24°C была немного завышена и имела большую стандартную ошибку для AAS и MMR при нормализации к среднему весу рыбы 346.9 г, потому что средний вес рыбы при этой температурной обработке составлял 253,9 г (см. рис. S1 для нормированного веса при каждой температуре). Однако при обработке при температуре 24 °C использовался только метод Чейза, который, как мы определили, не дает точной оценки MMR, и поэтому эта завышенная оценка не влияет на наши выводы. Все значения SMR, MMR и AAS с поправкой на вес, а также значения S crit приведены в таблице 2. Значения Q 10 представлены в таблице 3.
Все значения SMR, MMR и AAS с поправкой на вес, а также значения S crit приведены в таблице 2. Значения Q 10 представлены в таблице 3.
Рис. 4.
Влияние температуры на аэробную активность черного морского окуня. Аэробный диапазон (среднее значение ± стандартная ошибка) черного морского окуня, нормированный вокруг среднего веса 346,9 г при каждой температурной обработке с группой 30 хронических °C, обозначенной черным треугольником. Буквы обозначают значимость Tukey post hoc между группами, где точки данных, имеющие общую букву, существенно не различаются ( P <0,05). Кривые аэробного охвата были получены с помощью а) метода MMR Чейза ( y = 180 . 17 + 89 . 15x – 15 . 40x 2 –21 . 55x 3 ; Р 2 = 0 . 878 ) и B) метод купальника MMR MMR ( y = 314 . 36 + 63 . 29x — 68 . 26x 2 -19 . 65x 3 ;R 2 = 0 . 994 ).
36 + 63 . 29x — 68 . 26x 2 -19 . 65x 3 ;R 2 = 0 . 994 ).
https://doi.org/10.1371/journal.pone.0218390.g004
Критический %O
2 и метаболический индекс Анализ мощности показал, что размер выборки из четырех был достаточным для статистического тестирования (степень = 1 с n = 4, f = 1,71 и sig . уровень = 0,05). Это указывает на достаточную статистическую мощность при размере выборки из четырех рыб, поскольку изменчивость между группами была больше, чем между группами.Критический %O 2 (S крит ) значительно увеличился с повышением температуры (рис. 5; F 5 , 18 = 14,023, P ) и значительно увеличился с SMR (рис. 5) 6; F 1 , 22 = 107,6, P < 0 . Рис. 5. S крит увеличивается с повышением температуры. S crit представлено как %O 2 для каждой температурной обработки. 30 хроническая обработка при °C обозначена треугольником, и нет существенной разницы между 30 хронической °C и кратковременной акклиматизацией при 30 °C.Для этих точек данных была подобрана линейная регрессия (R 2 = 0,793, P <0,001), показывающая увеличение S crit (например, снижение толерантности к гипоксии) с повышением температуры. https://doi.org/10.1371/journal.pone.0218390.g005 Рис. 6. S crit зависимость от стандартной скорости метаболизма. S крит построен в зависимости от стандартной скорости метаболизма, измеренной во время эксперимента с гипоксией. Для этих точек данных была подобрана линейная регрессия (R 2 = 0.823, P <0,001) и показывает увеличение S crit по мере увеличения скорости метаболизма. https://doi. Рис. 7. Факторный аэробный охват и реакция метаболического индекса на температуру. Фактор аэробного объема (FAS) и метаболический индекс (MI) в зависимости от температуры. Тенденции иллюстрируют тенденцию к уменьшению обоих показателей по мере повышения температуры. И FAS, и MI являются безразмерными показателями, но оба показателя масштабируются одинаково. https://doi.org/10.1371/journal.pone.0218390.g007 В группе 30 хронических °C ААС, использующих оба метода MMR, значительно уменьшилось по сравнению с кратковременно акклиматизировавшимися рыбами при 30 °C, которые содержались при этой температуре только в течение недели (рис. 4). Основываясь на различиях Tukey post hoc , SMR существенно не изменился между 30 хронической °C и кратковременной акклиматизацией при 30 °C, но было значительное снижение MMR между кратковременной акклиматизацией 30 °C и 30 °C. Основная цель этого исследования заключалась в измерении аэробной активности и толерантности к гипоксии в диапазоне экологически значимых температур для оценки потенциального физиологического воздействия потепления океана на метаболически доступную среду обитания для северной популяции черного морского окуня. Мы измерили скорость потребления кислорода, показатель скорости метаболизма, следуя двум различным протоколам упражнений.Плавательный лоток показал гораздо более высокую скорость метаболизма, что указывает на то, что метод погони не вызывал MMR. Используя MMR с плавательным лотком, мы обнаружили, что пик ААС приходится на 24,4°C. S crit увеличивался с повышением температуры, что характерно для большинства (но не для всех, [62]) животных, включая рыб [57]. Абсолютный AS обычно увеличивается с температурой до точки, часто называемой «тепловым оптимумом», а затем снижается при более высоких температурах, что приводит к примерно колоколообразной кривой.Эта кривая была идентифицирована у рыб, которые включают, помимо прочего, молодь европейского морского окуня Dicentrarchus labrax [63], тюрбо Scophthalmus maximus [64], кижуча Oncorhynchus kisutch [65] и нерки. Черный морской окунь при 30 хроническом °C лечении не акклиматизировался, на что указывает отсутствие изменений SMR или S crit и значительное снижение их MMR и AS.Норин и др. [29] аналогичным образом обнаружили, что MMR и AAS у молодых баррамунди значительно снизились после 5 недель при самой высокой температуре исследования (38°C). Однако, в отличие от черного морского окуня в нашем исследовании, SMR молоди баррамунди также снизился после 5-недельного воздействия. Такая же реакция была также обнаружена у короткорогого бычка ( Myoxocephalus scorpius ), у которого SMR восстановился после содержания при 16°C в течение 8 недель до значений SMR, измеренных при 10°C [72]. S crit увеличивался при повышении температуры, что, скорее всего, было вызвано повышением SMR при более высоких температурах, что было показано в большинстве исследований гипоксии рыб (например,г. [37]; хотя см. [62]). В группе 30 хронической температуры °C не наблюдалось значительного снижения толерантности к гипоксии по сравнению с группой кратковременной акклиматизации при 30 °C, что согласуется с отсутствием изменений SMR между двумя обработками при 30 °C. Метод погони не выявил MMR у черного морского окуня, поскольку MMR при использовании метода с плавательным лотком был постоянно выше. Вопрос о том, какой метод, погоня или плавательный лоток, обеспечивает более надежное измерение MMR и AAS [23,75]. Таким образом, результаты этого исследования показывают, что северная популяция черного морского окуня достигает пика ААС при температуре ~24°C, что теплее, чем в северной части их ареала в NES США. МИ 3,8 в насыщенной воздухом воде, рассчитанный по S crit при 24°C, предполагает относительно ограниченные возможности для устойчивой активности при этой температуре [17].Мы предполагаем, что пик MMR и AAS указывает не на оптимальную температуру, а на максимально переносимую температуру, за пределами которой у черного морского окуня происходит сбой в некоторых субклеточных системах или системах органов, влияющих на работу мышц. Вес черного морского окуня (г), нормализованный к среднему значению 0 и стандартному отклонению 1 для каждой температурной обработки. 10.1371/journal.pone.0218390.s001 (TIFF) Каждый прерывистый цикл состоит из периодов промывки, ожидания и измерения. Количество времени, установленное для каждого компонента прерывистого цикла, указано для всех температурных обработок. 10.1371/journal.pone.0218390.s004 (DOCX) Мы благодарим Дага Земекиса и капитана Чада Хакера (R/V Tagged Fish) за помощь в сборе черного морского окуня; Richard Brill и Andrij Horodysky за понимание и предложения по дизайну исследования; студенты Морской и научно-технической академии за их помощь в животноводстве; и Лаура Паламара Наззаро за создание и предоставление карт распространения черного морского окуня. 5 1 Восточно-Китайский научно-исследовательский институт морского рыболовства, Китайская академия рыбохозяйственных наук, Шанхай, Китай 2 Академия океана и рыболовства Нинбо, Нинбо, Чжэцзян, Китай 1 Восточно-китайский научно-исследовательский институт морского рыболовства Китайской академии рыбохозяйственных наук, Шанхай, Китай 3 Ключевая лаборатория прикладной морской биотехнологии, Министерство образования, Университет Нинбо, Нинбо, Чжэцзян, Китай 1 Восточно-Китайский научно-исследовательский институт морского рыболовства, Китайская академия рыбохозяйственных наук, Шанхай, Китай Академический редактор: Мария Анхелес Эстебан 1 Восточно-Китайский научно-исследовательский институт морского рыболовства, Китайская академия рыбохозяйственных наук, Шанхай, Китай 2 Академия океана и рыболовства Нинбо, Нинбо, Чжэцзян, Китай 3 Ключевая лаборатория прикладной морской биотехнологии, Министерство образования, Университет Нинбо, Нинбо, Чжэцзян, Китай Поступила в редакцию 5 сентября 2019 г.; Принято 20 декабря 2019 г. Дополнительная информация 1: GC-MS TIC образцов мантии.(А): контроль (Б): 2 ч (В): 24 ч. Ордината показывает относительное массовое содержание, а абсцисса показывает время удерживания. DOI: 10.7717/peerj.8445/supp-1 Дополнительная информация 2: Анализ обогащения метаболитов после воздействия теплового стресса. А: 2 часа, Б: 24 часа. DOI: 10.7717/peerj.8445/supp-2 Дополнительная информация 3: Сводка метаболитов со значительными изменениями в мантии S. subcrenata через 2 часа после воздействия 32 ° C. DOI: 10.7717/peerj.8445/supp-3 Дополнительная информация 4: Сводка метаболитов со значительными изменениями в мантии S. subcrenata через 24 часа после воздействия 32 ° C. DOI: 10.7717/peerj.8445/supp-4 Дополнительная информация 5: Потребление кислорода и скорость выделения аммиака S. subcrenata после воздействия различных температур. DOI: 10.7717/peerj.8445/supp-5 Дополнительная информация 6: Анализ обогащения метаболитов между 2 и 24 часами после воздействия 32 °C. DOI: 10.7717/peerj.8445/supp-6 Дополнительная информация 7: Обогащение путей между 0–2 ч, 0–24 ч и 2–24 ч после воздействия 32 °C. DOI: 10. Дополнительная информация 8: Матрица данных метаболомного анализа. DOI: 10.7717/peerj.8445/supp-8 Дополнительная информация 9: Метаболиты со значительными изменениями в мантии S. subcrenata . DOI: 10.7717/peerj.8445/supp-9 Следующая информация была предоставлена относительно доступности данных: анализ обогащения метаболитов между 2 и 24 часами, и все пути, обогащенные после воздействия 32 ° C, доступны в дополнительных файлах. Морские моллюски обычно подвергаются тепловому стрессу.Для оценки влияния теплового стресса на физиологический метаболизм раковины ковчега Scapharca subcrenata моллюсков подвергали воздействию различных высоких температур (24, 28 и 32 °C) в течение 72 часов. Потребление кислорода и скорость выделения аммиака измеряли через 2, 12, 24, 48 и 72 часа. Ключевые слова: Тепловой стресс, Скорость потребления кислорода, Скорость выделения аммиака, Метаболомика, Scapharca subcrenata , Морские беспозвоночные экологическая ниша вида (Pörtner et al., 2006; Pörtner, 2010; Ezgeta-Balić et al., 2011). Температура также становится все более серьезным источником стресса для окружающей среды из-за повышения температуры морской воды в результате глобальных изменений климата.За последнее столетие глобальная температура поверхности воды увеличилась примерно на 0,7 °C (Hansen et al., 2006), и прогнозируется ее дальнейшее повышение (Wang et al., 2015). В ответ на изменения окружающей среды организмы обычно корректируют свою метаболическую физиологию, чтобы приспособиться к новым потребностям в энергии (Cheung & Lam, 1995; Lagerspetz, 2006; Zhang et al., 2017). Сообщалось, что температура может влиять на скорость метаболизма морских беспозвоночных, тем самым влияя на энергию, доступную для роста (González et al. Влияние теплового стресса на энергетический обмен морских двустворчатых моллюсков широко изучалось у многих видов (Соколова и др., 2012), такие как Mytilus galloprovincialis (Anestis et al., 2007), блюдечко Cellana toreuma (Han et al., 2013), Mercenaria mercenaria (Ivanina et al., 2013) и восточная устрица Crassostrea virginica (Casas et al., 2018). Среди многих показателей физиологических реакций на тепловую нагрузку поведение дыхания и скорость метаболизма на индивидуальном уровне (особенно скорость потребления кислорода) широко использовались для оценки физиологического состояния в ответ на толерантность к стрессу или адаптацию во время воздействия теплового стресса (Sobral & Widdows, 1997; Saucedo et al. Метаболомика относится к систематическому изучению химических процессов, в которых участвуют метаболиты. Измеряя уровни эндогенных низкомолекулярных метаболитов, метаболомику можно использовать для выявления биомаркеров, свидетельствующих о физиологических реакциях живых образцов на конкретные условия окружающей среды или культуры (Alfaro & Young, 2018).Многие аналитические платформы использовались для метаболомики, включая рамановскую спектроскопию, инфракрасную спектроскопию, ядерный магнитный резонанс (ЯМР) и многие методы масс-спектрометрии (МС), из которых ЯМР и МС являются наиболее широко применяемыми аналитическими инструментами из-за их достаточно высокой производительности и разрешения. свойства (Янг и Альфаро, 2018). Газовая хроматография в сочетании с масс-спектрометрией (ГХ/МС) является хорошо зарекомендовавшим себя аналитическим методом, который может обеспечить всестороннее и систематическое понимание всех метаболитов в биологических образцах (Tsugawa et al. Раковина ковчега Scapharca subcrenata обитает в илистых отложениях мелководных побережий Китая, Японии и Кореи (Nakamura, 2005), широко выращивается и употребляется в качестве популярного продукта питания в Китае и Корее (Jin, Ahn & Je, 2018 ).Из-за своего большого географического распространения популяции раковин ковчегов подвержены сильно различающимся тепловым условиям, таким как суточные колебания температуры и экстремально высокие температуры летом. Например, температура воды в ареале S. subcrenata залива Сяншань (Китай) колеблется от 6,7 °C до 33,0 °C (You & Jiao, 2011). Понимание реакции организмов на тепловой стресс требует глубокого понимания как их острых реакций, так и их компенсаторных акклиматизационных реакций на повышенную температуру (Pörtner et al., 2006). В настоящем исследовании измеряли потребление кислорода и скорость выделения аммиака у S. subcrenata в ответ на тепловой стресс. Кроме того, метаболический профиль в мантии был охарактеризован с использованием ГХ/МС для определения биомаркеров реакции на тепловой стресс. 001 ). Не было существенной разницы между 12 °C (19,65 ± 1,72% O 2 ), 17 °C (21,325 ± 1,75% O 2 ) и 22 °C (21.80 ± 1,21%O 2 ), но S крит значительно увеличивается при 27°С (31,60 ± 1,67%O 2 ) и далее при 30°С (37,875 ± 3,39%O 2 ). Однако недостоверность между 12, 17 и 22°C может быть связана с небольшим размером выборки. МИ уменьшался с повышением температуры (рис. 7), но критический МИ (<1) не наблюдался во время этого эксперимента даже при экстремально высоких температурах. Сообщалось о среднем критическом MI 3,3 для различных морских видов [17], что согласуется со значением, обнаруженным вблизи верхнего температурного предела (~ 24.4°C) найдено здесь и для MMR (рис. 7). FAS и MI имели одинаковую величину и имели одинаковую тенденцию к снижению с повышением температуры (рис. 7), что подтверждает интерпретацию MI как еще одного показателя AS.
001 ). Не было существенной разницы между 12 °C (19,65 ± 1,72% O 2 ), 17 °C (21,325 ± 1,75% O 2 ) и 22 °C (21.80 ± 1,21%O 2 ), но S крит значительно увеличивается при 27°С (31,60 ± 1,67%O 2 ) и далее при 30°С (37,875 ± 3,39%O 2 ). Однако недостоверность между 12, 17 и 22°C может быть связана с небольшим размером выборки. МИ уменьшался с повышением температуры (рис. 7), но критический МИ (<1) не наблюдался во время этого эксперимента даже при экстремально высоких температурах. Сообщалось о среднем критическом MI 3,3 для различных морских видов [17], что согласуется со значением, обнаруженным вблизи верхнего температурного предела (~ 24.4°C) найдено здесь и для MMR (рис. 7). FAS и MI имели одинаковую величину и имели одинаковую тенденцию к снижению с повышением температуры (рис. 7), что подтверждает интерпретацию MI как еще одного показателя AS.
 org/10.1371/journal.pone.0218390.g006
org/10.1371/journal.pone.0218390.g006 Хроническое воздействие высоких температур
 хронических обработок при °C (рис. 3).Не было существенной разницы в S crit между кратковременной акклиматизацией при 30°C и 30 хронической обработкой при °C (рис. 5).
хронических обработок при °C (рис. 3).Не было существенной разницы в S crit между кратковременной акклиматизацией при 30°C и 30 хронической обработкой при °C (рис. 5). Обсуждение
 Наблюдение, что S crit увеличивалось с температурой пропорционально SMR, в то время как MMR в плавательном желобе не увеличивалось, предполагает, что воздействие высокой температуры не изменяет способность к поглощению и транспорту кислорода.Хроническое воздействие температуры 30°C не привело к изменению SMR или S crit , но к значительному снижению AAS привело к уменьшению MMR (при использовании обоих методов), что предполагает отсутствие потери способности снабжать кислородом, согласно оценке S crit . Вместо этого это предполагает снижение мышечной функции, ограничивающее максимальную производительность при более длительном воздействии теплых температур, которое не ограничивается способностью снабжать кислородом.
Наблюдение, что S crit увеличивалось с температурой пропорционально SMR, в то время как MMR в плавательном желобе не увеличивалось, предполагает, что воздействие высокой температуры не изменяет способность к поглощению и транспорту кислорода.Хроническое воздействие температуры 30°C не привело к изменению SMR или S crit , но к значительному снижению AAS привело к уменьшению MMR (при использовании обоих методов), что предполагает отсутствие потери способности снабжать кислородом, согласно оценке S crit . Вместо этого это предполагает снижение мышечной функции, ограничивающее максимальную производительность при более длительном воздействии теплых температур, которое не ограничивается способностью снабжать кислородом. Oncorhynchus nerka [66]. Однако в некоторых исследованиях были обнаружены кривые с левым или правым наклоном (например, [27]), в то время как в других обнаружено, что ААС продолжает повышаться до критической (летальной) температуры для вида (т.г. [29, 67]). В нашем исследовании кривая AAS черного морского окуня имела более колоколообразную форму с предполагаемой оптимальной температурой 24,4°C. С учетом этого вывода южную часть ареала черного морского окуня следует считать термически оптимальной, поскольку температура у дна обычно составляет 24–26°C летом ([46,68]; из региональной модели ESPreSSO восточного побережья США, [69]). . Однако, если потеря ААС при более высоких температурах связана с нарушением мышечной деятельности, а не с потенциальным поступлением кислорода, то 24°C может представлять собой максимально переносимую температуру, а не температуру, обеспечивающую оптимальную работоспособность.В поддержку этой интерпретации можно отметить, что МИ (который точно соответствует FAS) снижается с повышением температуры до уровней (~3 при 27°C у черного морского окуня), которые, как известно, ограничивают географический ареал некоторых видов [17].
Oncorhynchus nerka [66]. Однако в некоторых исследованиях были обнаружены кривые с левым или правым наклоном (например, [27]), в то время как в других обнаружено, что ААС продолжает повышаться до критической (летальной) температуры для вида (т.г. [29, 67]). В нашем исследовании кривая AAS черного морского окуня имела более колоколообразную форму с предполагаемой оптимальной температурой 24,4°C. С учетом этого вывода южную часть ареала черного морского окуня следует считать термически оптимальной, поскольку температура у дна обычно составляет 24–26°C летом ([46,68]; из региональной модели ESPreSSO восточного побережья США, [69]). . Однако, если потеря ААС при более высоких температурах связана с нарушением мышечной деятельности, а не с потенциальным поступлением кислорода, то 24°C может представлять собой максимально переносимую температуру, а не температуру, обеспечивающую оптимальную работоспособность.В поддержку этой интерпретации можно отметить, что МИ (который точно соответствует FAS) снижается с повышением температуры до уровней (~3 при 27°C у черного морского окуня), которые, как известно, ограничивают географический ареал некоторых видов [17]. В то время как средняя придонная температура в южной части северной популяции черного морского окуня составляет около 24 °C в летние месяцы, все еще наблюдается постоянное расширение их ареала на север до более низких температур [70], что также позволяет предположить, что температура, вызывающая максимум ААС на самом деле не оптимален.Важно отметить, что ААС — это всего лишь измеренная способность снабжать кислородом при максимальных длительных физических нагрузках [25]. Требуемый объем других метаболических затрат (например, питание, пищеварение; [71]) изменяется с температурой неизвестным образом, а метаболические потребности могут меняться в зависимости от сезона и онтогенеза [54]. Таким образом, в этом случае ААС может быть неподходящим предиктором приспособленности и, по-видимому, не определяет оптимальную температуру и не коррелирует с распределением черного морского окуня. Когда ААС измеряют в лаборатории, важные, но не базовые энергетические потребности (т.е. пищеварение, размножение, рост) удаляются для измерения SMR.
В то время как средняя придонная температура в южной части северной популяции черного морского окуня составляет около 24 °C в летние месяцы, все еще наблюдается постоянное расширение их ареала на север до более низких температур [70], что также позволяет предположить, что температура, вызывающая максимум ААС на самом деле не оптимален.Важно отметить, что ААС — это всего лишь измеренная способность снабжать кислородом при максимальных длительных физических нагрузках [25]. Требуемый объем других метаболических затрат (например, питание, пищеварение; [71]) изменяется с температурой неизвестным образом, а метаболические потребности могут меняться в зависимости от сезона и онтогенеза [54]. Таким образом, в этом случае ААС может быть неподходящим предиктором приспособленности и, по-видимому, не определяет оптимальную температуру и не коррелирует с распределением черного морского окуня. Когда ААС измеряют в лаборатории, важные, но не базовые энергетические потребности (т.е. пищеварение, размножение, рост) удаляются для измерения SMR. Будущие исследования могут выиграть от изучения того, как изменяется аэробная способность, поскольку в эксперименты включаются другие энергетические параметры. Наконец, МИ, который можно использовать для прогнозирования ФАС, может указывать на верхний предел переносимой температуры у черного морского окуня и лучше объясняет распространение этих рыб на север. Этот показатель может быть более уместным для определения метаболически подходящей среды обитания черного морского окуня.
Будущие исследования могут выиграть от изучения того, как изменяется аэробная способность, поскольку в эксперименты включаются другие энергетические параметры. Наконец, МИ, который можно использовать для прогнозирования ФАС, может указывать на верхний предел переносимой температуры у черного морского окуня и лучше объясняет распространение этих рыб на север. Этот показатель может быть более уместным для определения метаболически подходящей среды обитания черного морского окуня. Снижение SMR может быть компенсаторной реакцией на высокие температуры за счет снижения энергетических затрат, но может сопровождаться снижением MMR.Важно отметить, что черный морской окунь в условиях 30 хронических °C, возможно, страдал от стресса в результате длительного содержания в неволе, что также могло снизить уровень ААС; время не позволяло провести контрольное хроническое испытание при более низкой температуре (хотя всех рыб выдерживали не менее 5 дней). Понимание потенциала акклиматизации черного морского окуня будет полезно для будущих исследований, посвященных последствиям хронического лечения при каждой тестируемой температуре.
Снижение SMR может быть компенсаторной реакцией на высокие температуры за счет снижения энергетических затрат, но может сопровождаться снижением MMR.Важно отметить, что черный морской окунь в условиях 30 хронических °C, возможно, страдал от стресса в результате длительного содержания в неволе, что также могло снизить уровень ААС; время не позволяло провести контрольное хроническое испытание при более низкой температуре (хотя всех рыб выдерживали не менее 5 дней). Понимание потенциала акклиматизации черного морского окуня будет полезно для будущих исследований, посвященных последствиям хронического лечения при каждой тестируемой температуре. Это говорит о том, что снижение MMR у 30 рыб с хронической температурой °C было вызвано снижением мышечной функции, а не проблемами снабжения кислородом. У черного морского окуня S crit ниже, чем у полосатого окуня Morone saxatilis [73] и летней камбалы Paralichthys dentatus [33] — двух важных видов, обитающих на всей территории МАБ, которые периодически испытывают гипоксию воды в летние месяцы.Однако по сравнению с рыбами, часто испытывающими гипоксию, такими как карась [74], черный морской окунь менее устойчив к гипоксии, особенно в более теплой воде. В соответствии с этим FAS и MI черного морского окуня уменьшались с повышением температуры (рис. 6). В летние месяцы, когда температура придонных вод вдоль побережья МАБ наиболее высока, периодически возникают гипоксические явления после большого цветения фитопланктона в поверхностных водах. В прошлом эти гипоксические события снижали PO 2 придонной воды ниже ~5.5 кПа (насыщение воздухом 26%; 2,2 мг л -1 при 14°C; [47]), обеспечивая МИ ~1,3 при этих температурах для черного морского окуня.
Это говорит о том, что снижение MMR у 30 рыб с хронической температурой °C было вызвано снижением мышечной функции, а не проблемами снабжения кислородом. У черного морского окуня S crit ниже, чем у полосатого окуня Morone saxatilis [73] и летней камбалы Paralichthys dentatus [33] — двух важных видов, обитающих на всей территории МАБ, которые периодически испытывают гипоксию воды в летние месяцы.Однако по сравнению с рыбами, часто испытывающими гипоксию, такими как карась [74], черный морской окунь менее устойчив к гипоксии, особенно в более теплой воде. В соответствии с этим FAS и MI черного морского окуня уменьшались с повышением температуры (рис. 6). В летние месяцы, когда температура придонных вод вдоль побережья МАБ наиболее высока, периодически возникают гипоксические явления после большого цветения фитопланктона в поверхностных водах. В прошлом эти гипоксические события снижали PO 2 придонной воды ниже ~5.5 кПа (насыщение воздухом 26%; 2,2 мг л -1 при 14°C; [47]), обеспечивая МИ ~1,3 при этих температурах для черного морского окуня. МИ 1,3 дает очень мало аэробных возможностей для деятельности, помимо базовых затрат на содержание, и, вероятно, не позволяет заниматься деятельностью, необходимой для выживания (например, поиск пищи, уклонение от хищников) и приспособленности (например, рост, размножение). Таким образом, такую среду можно терпеть в течение коротких периодов времени, но вряд ли она не способствует процветанию популяции. При 30°C даже вода, насыщенная воздухом, имеет индекс MI всего 2.6, что близко к физиологическим пределам многих видов [17]. Следовательно, при определении метаболически подходящей среды обитания необходимо учитывать как температуру, так и доступность кислорода, поскольку оба стрессора могут оказывать синергетическое воздействие на физиологию этого вида.
МИ 1,3 дает очень мало аэробных возможностей для деятельности, помимо базовых затрат на содержание, и, вероятно, не позволяет заниматься деятельностью, необходимой для выживания (например, поиск пищи, уклонение от хищников) и приспособленности (например, рост, размножение). Таким образом, такую среду можно терпеть в течение коротких периодов времени, но вряд ли она не способствует процветанию популяции. При 30°C даже вода, насыщенная воздухом, имеет индекс MI всего 2.6, что близко к физиологическим пределам многих видов [17]. Следовательно, при определении метаболически подходящей среды обитания необходимо учитывать как температуру, так и доступность кислорода, поскольку оба стрессора могут оказывать синергетическое воздействие на физиологию этого вида. Достижение максимальной скорости поглощения кислорода любым методом может зависеть от типа плавания исследуемых видов рыб, которые естественным образом проявляются в дикой природе. Норин и др. [29] целенаправленно использовали метод погони за молодью баррамунди ( Lates calcarifer ), хищником из засады, который обычно плавает быстрыми рывками. В других случаях рыба будет демонстрировать заметное потребление кислорода после тренировки (EPOC; [76]), иногда вызывая MMR через несколько минут или часов после прекращения тренировки [77]. Метод плавательного лотка может быть более экологически значимым для плавания на выносливость, демонстрируемого пелагическими рыбами, такими как тунцы [75].Различные методы MMR могут способствовать определенному типу плавания, которое может вызвать усталость рыбы до достижения MMR за счет истощения анаэробных запасов, что является важным фактором ААС [78]. Для этого исследования мы использовали протокол спринта для плавательного желоба, который вызывал такое же резкое плавание, как и в методе погони.
Достижение максимальной скорости поглощения кислорода любым методом может зависеть от типа плавания исследуемых видов рыб, которые естественным образом проявляются в дикой природе. Норин и др. [29] целенаправленно использовали метод погони за молодью баррамунди ( Lates calcarifer ), хищником из засады, который обычно плавает быстрыми рывками. В других случаях рыба будет демонстрировать заметное потребление кислорода после тренировки (EPOC; [76]), иногда вызывая MMR через несколько минут или часов после прекращения тренировки [77]. Метод плавательного лотка может быть более экологически значимым для плавания на выносливость, демонстрируемого пелагическими рыбами, такими как тунцы [75].Различные методы MMR могут способствовать определенному типу плавания, которое может вызвать усталость рыбы до достижения MMR за счет истощения анаэробных запасов, что является важным фактором ААС [78]. Для этого исследования мы использовали протокол спринта для плавательного желоба, который вызывал такое же резкое плавание, как и в методе погони. Однако во время протокола погони черный морской окунь почти сразу же переключился на импульсное плавание, сопровождаемое быстрыми поворотами/переворотами, по сравнению с более медленным переходом и непрерывным резким плаванием в плавательном желобе.Различия в MMR между двумя методами могли быть связаны с разными типами плавания, продолжительностью и/или скоростью, которые могли задействовать больше анаэробных ресурсов [79] в методе погони, что приводило к истощению до достижения MMR.
Однако во время протокола погони черный морской окунь почти сразу же переключился на импульсное плавание, сопровождаемое быстрыми поворотами/переворотами, по сравнению с более медленным переходом и непрерывным резким плаванием в плавательном желобе.Различия в MMR между двумя методами могли быть связаны с разными типами плавания, продолжительностью и/или скоростью, которые могли задействовать больше анаэробных ресурсов [79] в методе погони, что приводило к истощению до достижения MMR. В нашем исследовании использовались только особи из северной стаи, которые были собраны летом у береговой линии Нью-Джерси. Метаболические исследования южной стаи (к югу от мыса Хаттерас, Северная Каролина) и/или особей северной стаи в водах за пределами Нью-Джерси могут выявить различия в некоторых из этих физиологических показателей.Однако распространение северной популяции черного морского окуня сместилось к северу [7], и температура на дне этого вновь расширенного местообитания почти на 10°C ниже, чем их кажущийся температурный оптимум для ААС. Мы считаем, что предпочтение более прохладной воды отражает физиологические ограничения при более высоких температурах, в том числе возможное ограничение снабжения кислородом по сравнению с потребностью в росте и размножении (снижение метаболического индекса), несмотря на сохранение способности снабжения кислородом. Однако многие другие факторы, в том числе доступность пищи, дополнительные энергетические затраты (напр.например, уклонение от хищников, спаривание) или более низкие оптимальные температуры для других важных процессов.
В нашем исследовании использовались только особи из северной стаи, которые были собраны летом у береговой линии Нью-Джерси. Метаболические исследования южной стаи (к югу от мыса Хаттерас, Северная Каролина) и/или особей северной стаи в водах за пределами Нью-Джерси могут выявить различия в некоторых из этих физиологических показателей.Однако распространение северной популяции черного морского окуня сместилось к северу [7], и температура на дне этого вновь расширенного местообитания почти на 10°C ниже, чем их кажущийся температурный оптимум для ААС. Мы считаем, что предпочтение более прохладной воды отражает физиологические ограничения при более высоких температурах, в том числе возможное ограничение снабжения кислородом по сравнению с потребностью в росте и размножении (снижение метаболического индекса), несмотря на сохранение способности снабжения кислородом. Однако многие другие факторы, в том числе доступность пищи, дополнительные энергетические затраты (напр.например, уклонение от хищников, спаривание) или более низкие оптимальные температуры для других важных процессов. Это говорит о том, что AAS может быть не самым подходящим предиктором пригодности среды обитания для этого вида. Кроме того, за последнее десятилетие увеличился размер северной популяции черного морского окуня [71], и это увеличение биомассы могло оттеснить часть популяции на север. Несмотря на это, представленные здесь эксперименты с хроническим воздействием предполагают небольшую способность физиологической адаптации к будущим температурам.Термальная среда обитания черного морского окуня может значительно сократиться в южной части МАБ, поскольку температура придонной воды достигает >27°C, и продолжать расширяться в северную часть МАБ, поскольку океанские воды продолжают нагреваться, что влияет на рыбный промысел в этих двух регионах.
Это говорит о том, что AAS может быть не самым подходящим предиктором пригодности среды обитания для этого вида. Кроме того, за последнее десятилетие увеличился размер северной популяции черного морского окуня [71], и это увеличение биомассы могло оттеснить часть популяции на север. Несмотря на это, представленные здесь эксперименты с хроническим воздействием предполагают небольшую способность физиологической адаптации к будущим температурам.Термальная среда обитания черного морского окуня может значительно сократиться в южной части МАБ, поскольку температура придонной воды достигает >27°C, и продолжать расширяться в северную часть МАБ, поскольку океанские воды продолжают нагреваться, что влияет на рыбный промысел в этих двух регионах. Дополнительная информация
S1 Рис. Номализованный вес рыбы при каждой температурной обработке.
 Группа обработки при температуре 24°C состоит только из рыб, выловленных в 2016 г., и, как видно по разнице почти в одно стандартное отклонение, они были намного меньше остальных экспериментальных рыб.
Группа обработки при температуре 24°C состоит только из рыб, выловленных в 2016 г., и, как видно по разнице почти в одно стандартное отклонение, они были намного меньше остальных экспериментальных рыб. S1 Таблица. Продолжительность всех прерывистых циклов при каждой температуре.
Благодарности
 Мы также признательны персоналу лаборатории Джеймса Дж. Ховарда NOAA за их поддержку и помощь на протяжении всего исследования.
Мы также признательны персоналу лаборатории Джеймса Дж. Ховарда NOAA за их поддержку и помощь на протяжении всего исследования. Каталожные номера
 М.А., Дони С.К. Тридцать три года потепления бентоса в океане вдоль Ю.S. Северо-восточный континентальный шельф и склон: закономерности, движущие силы и экологические последствия. J Geophys Res Ocean. 2017;(122): 1–16. пмид:29497591
М.А., Дони С.К. Тридцать три года потепления бентоса в океане вдоль Ю.S. Северо-восточный континентальный шельф и склон: закономерности, движущие силы и экологические последствия. J Geophys Res Ocean. 2017;(122): 1–16. пмид:29497591 Кляйснер К.М., Фогарти М.Дж., МакГи С., Барнетт А., Фратантони П., Грин Дж. и др. Влияние скорости субрегионального климата на распространение и пространственную протяженность сообществ морских видов.ПЛОС Один. 2016;11(2): e0149220. пмид:265
Кляйснер К.М., Фогарти М.Дж., МакГи С., Барнетт А., Фратантони П., Грин Дж. и др. Влияние скорости субрегионального климата на распространение и пространственную протяженность сообществ морских видов.ПЛОС Один. 2016;11(2): e0149220. пмид:265 Пинский М.Л., Рейгондо Г., Кэдделл Р., Паласиос-Абрантес Дж., Спийкерс Дж., Чунг В.В.Л. Подготовка управления океаном для видов, находящихся в движении. Наука. 2018;360(6394): 1189–1192. пмид:29
Пинский М.Л., Рейгондо Г., Кэдделл Р., Паласиос-Абрантес Дж., Спийкерс Дж., Чунг В.В.Л. Подготовка управления океаном для видов, находящихся в движении. Наука. 2018;360(6394): 1189–1192. пмид:29 Е., Тейлор М.Д., Ватанабэ Ю.Ю., Такахаши А. Температурная зависимость производительности рыб в дикой природе: связи с биогеографией видов и физиологической термостойкостью. Функция Экол. 2016;30(6): 903–912.
Е., Тейлор М.Д., Ватанабэ Ю.Ю., Такахаши А. Температурная зависимость производительности рыб в дикой природе: связи с биогеографией видов и физиологической термостойкостью. Функция Экол. 2016;30(6): 903–912. Норин Т., Кларк Т.Д. Измерение и значимость максимальной скорости метаболизма у рыб. Дж. Фиш Биол. 2016;88(1): 122–151. пмид:26586591
Норин Т., Кларк Т.Д. Измерение и значимость максимальной скорости метаболизма у рыб. Дж. Фиш Биол. 2016;88(1): 122–151. пмид:26586591 Физиол Биохим Зоол. 2012;85(2): 107–19. пмид:22418704
Физиол Биохим Зоол. 2012;85(2): 107–19. пмид:22418704 Экология. 2011;92(8): 1565–1572 пмид:213
Экология. 2011;92(8): 1565–1572 пмид:213 Консерв Физиол.2013;1
Консерв Физиол.2013;1 Рыба побережья Мар. 2012;4(1): 391–402.
Рыба побережья Мар. 2012;4(1): 391–402. 1933.
1933. Викельски М., Кук С.Дж. Физиология сохранения. Тенденции Экол Эвол. 2006;21(1): 38–46.пмид:16701468
Викельски М., Кук С.Дж. Физиология сохранения. Тенденции Экол Эвол. 2006;21(1): 38–46.пмид:16701468 пмид:23842625
пмид:23842625 Шабо Д., Стеффенсен Дж. Ф., Фаррелл А. П. Определение стандартной скорости обмена веществ у рыб. Дж. Фиш Биол. 2016;88(1): 81–121. пмид:26768973
Шабо Д., Стеффенсен Дж. Ф., Фаррелл А. П. Определение стандартной скорости обмена веществ у рыб. Дж. Фиш Биол. 2016;88(1): 81–121. пмид:26768973 Маллех Р., Лагардер Дж. П. Влияние температуры и концентрации растворенного кислорода на скорость метаболизма палтуса и взаимосвязь между объемом метаболизма и потребностью в корме. Дж. Фиш Биол. 2002;60(5): 1105–1115.
Маллех Р., Лагардер Дж. П. Влияние температуры и концентрации растворенного кислорода на скорость метаболизма палтуса и взаимосвязь между объемом метаболизма и потребностью в корме. Дж. Фиш Биол. 2002;60(5): 1105–1115. Консерв Физиол. 2016;4(1): корова009. пмид:27382472
Консерв Физиол. 2016;4(1): корова009. пмид:27382472 Proc R Soc Biol. 2014;281: 20141490. pmid:25232133
Proc R Soc Biol. 2014;281: 20141490. pmid:25232133 Рейди С.П., Нельсон Дж.А., Тан Ю., Керр С.Р.Скорость обмена веществ после тренировки у атлантической трески и ее зависимость от метода истощения. Дж. Фиш Биол. 1995; 47: 377–386.
Рейди С.П., Нельсон Дж.А., Тан Ю., Керр С.Р.Скорость обмена веществ после тренировки у атлантической трески и ее зависимость от метода истощения. Дж. Фиш Биол. 1995; 47: 377–386. Метаболический ответ SCAPAPHARCA подкроната для теплового напряжения с использованием метаболомики на основе GC / MS
, 1 , 2 , 1 , 3 и 1 Yazhou Jiang
Haifeng Jiao
Peng Sun
Fei Yin
Baojun Tang


 7717/peerj.8445/supp-7
7717/peerj.8445/supp-7 Abstract
 Результаты показали, что скорость метаболизма оболочки ковчега значительно увеличивалась с усилением теплового стресса, сопровождающегося смертностью в ответ на длительное воздействие. Метаболомический подход, основанный на газовой хроматографии в сочетании с масс-спектрометрией, был дополнительно применен для оценки изменений метаболитов в мантии оболочки ковчега при 32 °C.Кроме того, для различных метаболитов был проведен многофакторный анализ и анализ путей. Результаты показали, что тепловой стресс вызывал изменения в энергетическом обмене, обмене аминокислот, осмотической регуляции, метаболизме углеводов и метаболизме липидов через различные метаболические пути. Эти результаты согласуются со значительными изменениями скорости потребления кислорода и скорости экскреции аммиака. Настоящее исследование способствует пониманию воздействия теплового стресса на приливно-отливных двустворчатых моллюсков и проясняет взаимосвязь между реакциями на индивидуальном уровне и лежащей в основе молекулярной метаболической динамикой.
Результаты показали, что скорость метаболизма оболочки ковчега значительно увеличивалась с усилением теплового стресса, сопровождающегося смертностью в ответ на длительное воздействие. Метаболомический подход, основанный на газовой хроматографии в сочетании с масс-спектрометрией, был дополнительно применен для оценки изменений метаболитов в мантии оболочки ковчега при 32 °C.Кроме того, для различных метаболитов был проведен многофакторный анализ и анализ путей. Результаты показали, что тепловой стресс вызывал изменения в энергетическом обмене, обмене аминокислот, осмотической регуляции, метаболизме углеводов и метаболизме липидов через различные метаболические пути. Эти результаты согласуются со значительными изменениями скорости потребления кислорода и скорости экскреции аммиака. Настоящее исследование способствует пониманию воздействия теплового стресса на приливно-отливных двустворчатых моллюсков и проясняет взаимосвязь между реакциями на индивидуальном уровне и лежащей в основе молекулярной метаболической динамикой.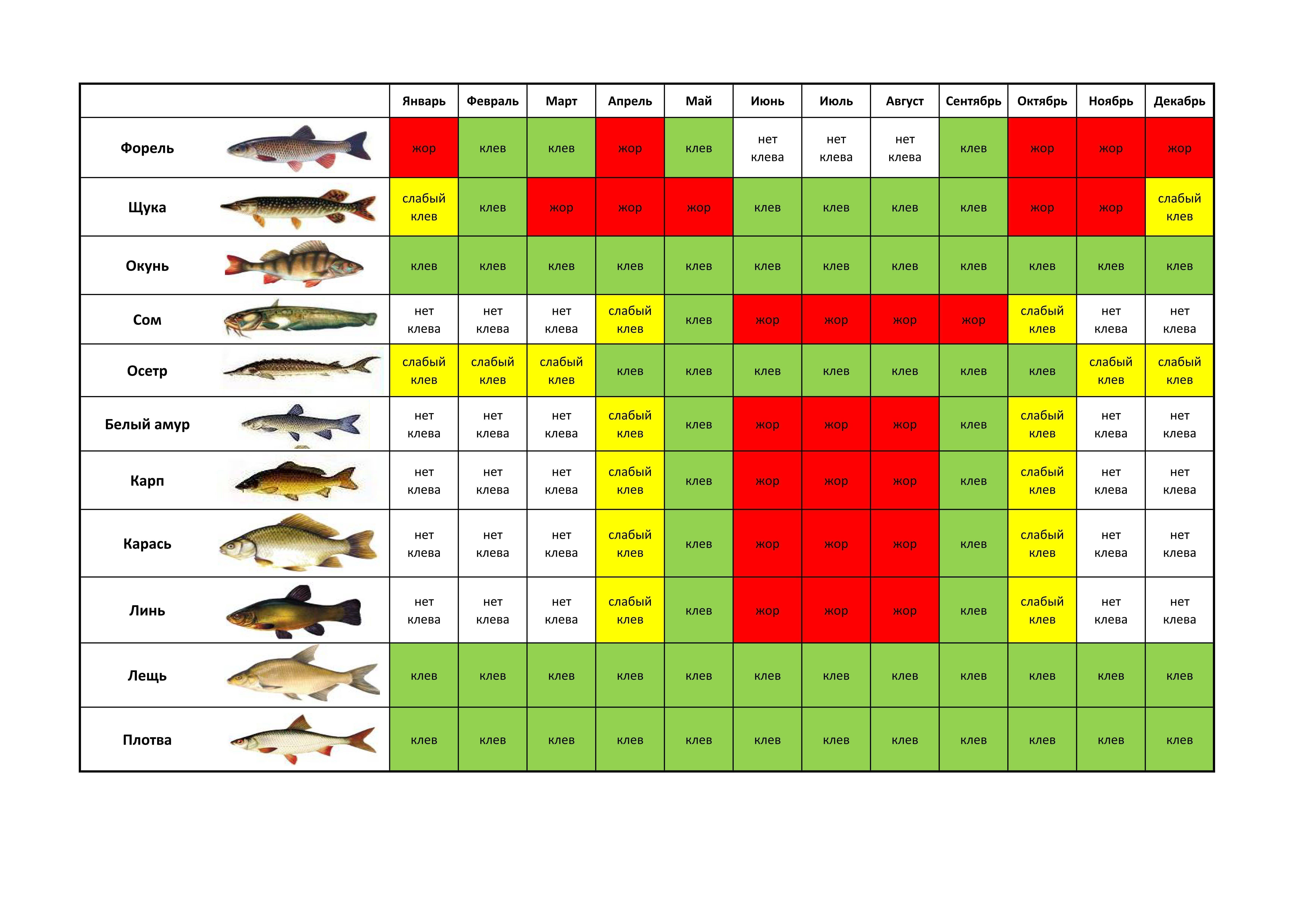
Введение
 , 2002). Приливно-отливные двустворчатые моллюски часто сталкиваются с экстремальным тепловым стрессом (Han et al., 2013) и создают надежные модели для изучения адаптации к сильно меняющимся условиям (Davenport & Davenport, 2005; Wang et al., 2015). Таким образом, изучение основных метаболических изменений может помочь понять физиологические изменения, происходящие у двустворчатых моллюсков в ответ на тепловой стресс.
, 2002). Приливно-отливные двустворчатые моллюски часто сталкиваются с экстремальным тепловым стрессом (Han et al., 2013) и создают надежные модели для изучения адаптации к сильно меняющимся условиям (Davenport & Davenport, 2005; Wang et al., 2015). Таким образом, изучение основных метаболических изменений может помочь понять физиологические изменения, происходящие у двустворчатых моллюсков в ответ на тепловой стресс. , 2004; Сара и др., 2008 г.; Дауд и Сомеро, 2013 г.; Фриск, Штеффенсен и Сков, 2013 г.; Ван и др., 2015 г.; Касас и др., 2018). Успешная устойчивость или толерантность требует молекулярной адаптации для компенсации нарушенного метаболизма, вызванного изменениями температуры (Lim et al., 2016). Более того, исследование корреляции между ответами на индивидуальном уровне и молекулярными изменениями полезно для лучшего понимания ответов и регулирующих механизмов с общей точки зрения.В последнее время исследования все больше сосредотачиваются на молекулярной адаптации или устойчивости морских двустворчатых моллюсков к тепловому стрессу, а также на новых аналитических методах, таких как транскриптомика (Lim et al., 2016; Nie et al., 2017; Yang et al., 2017; Juárez et al., 2017). al., 2018; Zhang et al., 2019) и метаболомику (Ellis et al., 2014; Digilio et al., 2016). Ткань мантии моллюсков выполняет множество функций, включая секрецию связок и сенсорную деятельность; кроме того, эта ткань очень чувствительна к внешним раздражителям (Artigaud et al.
, 2004; Сара и др., 2008 г.; Дауд и Сомеро, 2013 г.; Фриск, Штеффенсен и Сков, 2013 г.; Ван и др., 2015 г.; Касас и др., 2018). Успешная устойчивость или толерантность требует молекулярной адаптации для компенсации нарушенного метаболизма, вызванного изменениями температуры (Lim et al., 2016). Более того, исследование корреляции между ответами на индивидуальном уровне и молекулярными изменениями полезно для лучшего понимания ответов и регулирующих механизмов с общей точки зрения.В последнее время исследования все больше сосредотачиваются на молекулярной адаптации или устойчивости морских двустворчатых моллюсков к тепловому стрессу, а также на новых аналитических методах, таких как транскриптомика (Lim et al., 2016; Nie et al., 2017; Yang et al., 2017; Juárez et al., 2017). al., 2018; Zhang et al., 2019) и метаболомику (Ellis et al., 2014; Digilio et al., 2016). Ткань мантии моллюсков выполняет множество функций, включая секрецию связок и сенсорную деятельность; кроме того, эта ткань очень чувствительна к внешним раздражителям (Artigaud et al. , 2015). Ткань мантии использовалась для транскриптомного, протеомного или метаболического анализа во многих исследованиях (Artigaud et al., 2014, 2015; Wei et al., 2015).
, 2015). Ткань мантии использовалась для транскриптомного, протеомного или метаболического анализа во многих исследованиях (Artigaud et al., 2014, 2015; Wei et al., 2015). , 2011; Нгуен и Альфаро, 2019а). Метаболомика на основе ГХ/МС широко применялась для изучения физиологических реакций водных организмов на стрессовые факторы окружающей среды, в том числе патогенные инфекции, загрязнители воды и воздействие воздуха, и были успешно идентифицированы многие метаболиты и связанные с ними пути (Guo et al., 2014; Ji et al., 2016; Chen et al., 2015; Nguyen et al., 2018a, 2018c; 2019, Alfaro, Nguyen & Mellow, 2019).
, 2011; Нгуен и Альфаро, 2019а). Метаболомика на основе ГХ/МС широко применялась для изучения физиологических реакций водных организмов на стрессовые факторы окружающей среды, в том числе патогенные инфекции, загрязнители воды и воздействие воздуха, и были успешно идентифицированы многие метаболиты и связанные с ними пути (Guo et al., 2014; Ji et al., 2016; Chen et al., 2015; Nguyen et al., 2018a, 2018c; 2019, Alfaro, Nguyen & Mellow, 2019). Однако имеется мало информации о физиологических реакциях S. subcrenata на столь выраженный тепловой стресс.
Однако имеется мало информации о физиологических реакциях S. subcrenata на столь выраженный тепловой стресс. Материалы и методы.
Животные и тепловой стресс. .Температура воды в месте отбора проб 19,6 °С. Моллюсков содержали в стеклянном аквариуме при температуре 20 ± 0,5 °С с постоянной аэрацией. Чтобы свести к минимуму влияние размера тела на метаболические реакции на тепловой стресс, использовали только особей с одинаковой длиной раковины (28,11 ± 1,36 мм).
Моллюсков случайным образом разделили на четыре группы (70 моллюсков для обработки при 20, 24 и 28 °C и 80 моллюсков для обработки при 32 °C) и поместили в четыре водяные бани объемом 60 л, заполненные аэрированной морской водой, которые были соединены к регулятору температуры. Температуру морской воды постепенно повышали с 20 до 24, 28 и 32 °С в течение 2, 4 и 6 часов соответственно. Затем температуру поддерживали постоянной в течение следующих 72 часов. Через 2, 12, 24, 48 и 72 часа воздействия различных уровней теплового стресса измеряли как скорость потребления кислорода, так и скорость выделения аммиака у S. subcrenata . Во время эксперимента морская вода в каждом резервуаре обновлялась ежедневно.
Температуру морской воды постепенно повышали с 20 до 24, 28 и 32 °С в течение 2, 4 и 6 часов соответственно. Затем температуру поддерживали постоянной в течение следующих 72 часов. Через 2, 12, 24, 48 и 72 часа воздействия различных уровней теплового стресса измеряли как скорость потребления кислорода, так и скорость выделения аммиака у S. subcrenata . Во время эксперимента морская вода в каждом резервуаре обновлялась ежедневно.
На основании результатов измерения потребления кислорода и выделения аммиака через 2 и 24 часа после постепенного повышения температуры морской воды с 20 °C до 32 °C было отобрано шесть повторностей образцов мантии.Все образцы были немедленно заморожены в жидком азоте и сохранены при температуре -80°C для дальнейшего метаболомного анализа.
Измерение скорости потребления кислорода и скорости выделения аммиака
И потребление кислорода, и скорость выделения аммиака определяли в стеклянной дыхательной камере объемом 1500 мл. Двух моллюсков запечатывали на 2 ч в камеру, наполненную морской водой, насыщенной кислородом. Концентрацию кислорода в этой камере измеряли по стандартной методике (Stickland & Parsons, 1968).Концентрацию NH 4 + -N определяли фенол-гипохлоритным методом (Solorzano, 1969). Образцы отдельных моллюсков отбирали для измерения через 1, 11, 23, 47 и 71 час после воздействия теплового стресса. Поскольку каждый цикл измерения охватывал 2-часовой период, измеренные значения представляют собой средние значения за 1–3, 11–13, 23–25, 47–49 и 71–73 ч соответственно. Результаты представлены в виде скоростей через 2, 12, 24, 48 и 72 часа. Каждое измерение проводили в трех повторностях, контрольной служила камера без моллюсков.После измерений определяли сухую массу мягких частей каждого моллюска после сушки при 65 °С в течение 24 часов.
Концентрацию кислорода в этой камере измеряли по стандартной методике (Stickland & Parsons, 1968).Концентрацию NH 4 + -N определяли фенол-гипохлоритным методом (Solorzano, 1969). Образцы отдельных моллюсков отбирали для измерения через 1, 11, 23, 47 и 71 час после воздействия теплового стресса. Поскольку каждый цикл измерения охватывал 2-часовой период, измеренные значения представляют собой средние значения за 1–3, 11–13, 23–25, 47–49 и 71–73 ч соответственно. Результаты представлены в виде скоростей через 2, 12, 24, 48 и 72 часа. Каждое измерение проводили в трех повторностях, контрольной служила камера без моллюсков.После измерений определяли сухую массу мягких частей каждого моллюска после сушки при 65 °С в течение 24 часов.
Экстракция метаболитов
Для экстракции метаболитов 30 мг точной навески влажного образца переносили в пробирку Эппендорфа объемом 1,5 мл с двумя небольшими стальными шариками (диаметром 1,50 мм) для измельчения. К каждому образцу добавляли аликвоту 20 мкл 2-хлор-1-фенилаланина (0,3 мг/мл), растворенного в метаноле в качестве внутреннего стандарта, и 600 мкл смеси метанола и воды (4/1, об. /об.).Все образцы охлаждали до -80 °C в течение 2 мин, а затем измельчали при частоте 60 Гц в течение 2 мин. После встряхивания измельченные образцы обрабатывали ультразвуком в течение 10 минут при температуре окружающей среды и охлаждали до -20 °C в течение 30 минут. Затем образцы центрифугировали при 13 000 об/мин, 4 °С в течение 15 мин (центрифуга Eppendorf Centrifuge 5427 R; Гамбург, Германия). Супернатант (400 мкл) сушили в центробежной сушилке с концентрацией вымораживанием (Christ RVC 2-33IR; Osterode, Германия) и затем добавляли 80 мкл 15 мг/мл гидрохлорида метоксиламина в пиридине.Полученную смесь встряхивали в течение 2 мин и инкубировали при 37°С в течение 90 мин. Затем добавляли 80 мкл бис(триметилсилил)трифторацетамида (БСТФА) (с 1% триметилхлорсилана) и 20 мкл н-гексана, перемешивали на вортексе в течение 2 мин, а затем дериватизировали при 70°С в течение 60 мин. Полученную смесь выдерживали при температуре окружающей среды в течение 30 минут перед анализом ГХ-МС.
/об.).Все образцы охлаждали до -80 °C в течение 2 мин, а затем измельчали при частоте 60 Гц в течение 2 мин. После встряхивания измельченные образцы обрабатывали ультразвуком в течение 10 минут при температуре окружающей среды и охлаждали до -20 °C в течение 30 минут. Затем образцы центрифугировали при 13 000 об/мин, 4 °С в течение 15 мин (центрифуга Eppendorf Centrifuge 5427 R; Гамбург, Германия). Супернатант (400 мкл) сушили в центробежной сушилке с концентрацией вымораживанием (Christ RVC 2-33IR; Osterode, Германия) и затем добавляли 80 мкл 15 мг/мл гидрохлорида метоксиламина в пиридине.Полученную смесь встряхивали в течение 2 мин и инкубировали при 37°С в течение 90 мин. Затем добавляли 80 мкл бис(триметилсилил)трифторацетамида (БСТФА) (с 1% триметилхлорсилана) и 20 мкл н-гексана, перемешивали на вортексе в течение 2 мин, а затем дериватизировали при 70°С в течение 60 мин. Полученную смесь выдерживали при температуре окружающей среды в течение 30 минут перед анализом ГХ-МС.
Образцы для контроля качества (КК) были подготовлены путем объединения всех образцов в том же объеме, что и аналитические образцы, а затем проанализированы с использованием того же метода. QC вводили через равные промежутки времени (каждые 10 образцов) на протяжении всего аналитического процесса, чтобы обеспечить воспроизводимость измерений ГХ-МС.
QC вводили через равные промежутки времени (каждые 10 образцов) на протяжении всего аналитического процесса, чтобы обеспечить воспроизводимость измерений ГХ-МС.
Анализ ГХ/МС
Производные образцы анализировали с использованием системы ГХ Agilent 7890A, соединенной с системой МСД Agilent 5975C (Agilent, Санта-Клара, Калифорния, США). Для разделения производных использовали капиллярную колонку с плавленым кварцем HP-5MS (30 м × 0,25 мм × 0,25 мкм, Agilent). Гелий (>99,999%) использовали в качестве газа-носителя при постоянном расходе 6.0 мл/мин через колонку. Температуру инжектора поддерживали на уровне 280°C, а объем впрыска составлял 1 мкл в режиме без разделения. Начальная температура печи была 60 °С, повышалась до 125 °С со скоростью 8 °С/мин, до 190 °С со скоростью 10 °С/мин, до 210 °С со скоростью 4 °С. /мин, до 310 °С со скоростью 20 °С/мин и, наконец, температуру 310 °С поддерживали в течение 8,5 мин. Температуры МС-квадруполя и электронного удара ионного источника (ЭУ) были установлены на 150 °С и 230 °С соответственно, а энергия столкновения составляла 70 эВ. Массовые данные были получены в режиме полного сканирования (m/z 50–600), а время задержки растворителя было установлено на 5 минут.
Массовые данные были получены в режиме полного сканирования (m/z 50–600), а время задержки растворителя было установлено на 5 минут.
Статистический анализ
Для результатов скорости потребления кислорода и скорости экскреции аммиака односторонний ANOVA и множественные сравнения были выполнены с помощью статистического программного обеспечения SPSS 11.5, и значение P менее 0,05 считалось статистически значимым.
Данные МС, полученные с помощью ГХ-МС, были проанализированы с помощью программного обеспечения ChromaTOF (v4.34; LECO, St.Джозеф, Мичиган, США). Метаболиты были идентифицированы по базе данных Fiehn с использованием метода, описанного Mishra, Gong & Kelly (2017). Вкратце, после сопоставления с компонентом Statistic Compare был получен файл CSV с наборами трехмерных данных, включая информацию о образце, название пика, время удерживания, m/z и интенсивность пика. Для контроля качества использовали внутренний стандарт. Внутренние стандарты и любые идентифицированные псевдоположительные пики, такие как пики, вызванные шумом, просачиванием колонки и процедурой дериватизации BSTFA, были удалены из набора данных. Пики одних и тех же метаболитов объединяли.
Пики одних и тех же метаболитов объединяли.
Полученные данные были нормализованы к общей площади пика каждого образца с использованием Excel 2007 (Microsoft, Редмонд, Вашингтон, округ Колумбия, США) и были импортированы в программный пакет SIMCA (v14.0; Umetrics, Умео, Швеция), где основная были выполнены компонентный анализ (PCA), частичный дискриминантный анализ наименьших квадратов (PLS-DA) и ортогональный частичный дискриминантный анализ наименьших квадратов (OPLS-DA). Область T2 Хотеллинга, показанная в виде эллипса на графиках оценок моделей, использовалась для определения 95% доверительного интервала смоделированной вариации.Качество моделей описывалось значениями R 2 X или R 2 Y и Q 2 . R 2 X или R 2 Y определяются как доля дисперсии данных, которая может быть объяснена моделями и указывает на качество соответствия. Q 2 определяется как доля дисперсии данных, предсказанная моделью, и указывает на предсказуемость, рассчитанную с помощью процедуры перекрестной проверки.По умолчанию в SIMCA была выполнена перекрестная проверка из семи раундов, чтобы определить оптимальное количество основных компонентов и избежать переобучения модели. Модели OPLS-DA также были подтверждены анализом перестановок (200 раз).
Q 2 определяется как доля дисперсии данных, предсказанная моделью, и указывает на предсказуемость, рассчитанную с помощью процедуры перекрестной проверки.По умолчанию в SIMCA была выполнена перекрестная проверка из семи раундов, чтобы определить оптимальное количество основных компонентов и избежать переобучения модели. Модели OPLS-DA также были подтверждены анализом перестановок (200 раз).
Различные метаболиты были выбраны на основе комбинации значений статистически значимого порога переменного влияния на проекцию (VIP), полученных из модели OPLS-DA, и значений P из двустороннего теста Стьюдента t на нормированные площади пиков.Были включены метаболиты со значениями VIP более 1,0 и значениями P менее 0,05.
Результаты
Показатели выживаемости
Повышенный тепловой стресс увеличил смертность экспериментальных моллюсков. Выживаемость S. subcrenata при температуре морской воды 20, 24, 28 и 32 ° C составила 97,14%, 92,85%, 84,28% и 75% соответственно. Большинство смертей произошло в течение 24 часов после термического воздействия.
Большинство смертей произошло в течение 24 часов после термического воздействия.
Скорость метаболизма
После повышения температуры до 24 °C скорость потребления кислорода S.subcrenata снижалась в течение 2 часов, после чего наблюдалось значительное увеличение через 24 и 48 часов ( P <0,05 и P <0,01 соответственно; ). После воздействия стресса при 28 °C и 32 °C скорость потребления кислорода значительно увеличилась через 2, 24, 48 и 72 часа ( P < 0,05, 0,01). Увеличение было незначительным в течение 12 ч, хотя скорость потребления кислорода все еще была выше, чем в контрольной группе.
Показатели потребления кислорода S. subcrenata после воздействия различных температур.Звездочки указывают на значимые различия (* P < 0,05; ** P < 0,01) между стрессовой и контрольной группой.
После воздействия теплового стресса скорость выделения аммиака у S. subcrenata сначала увеличилась, затем уменьшилась и снова увеличилась (). S. subcrenata , подвергнутые тепловому стрессу при 24 °C, продемонстрировали более высокое выделение аммиака через 12 часов по сравнению с контрольной группой ( P <0,01). Моллюски, подвергшиеся тепловому стрессу при температуре 28 °C, показали значительно более высокие скорости выделения аммиака через 2, 12 и 72 часа ( P < 0.05 и P < 0,01 соответственно). Скорость выделения аммиака у S. subcrenata при температуре 32 °C была значительно выше, чем у контрольной группы через 2, 24, 48 и 72 ч ( P <0,01).
S. subcrenata , подвергнутые тепловому стрессу при 24 °C, продемонстрировали более высокое выделение аммиака через 12 часов по сравнению с контрольной группой ( P <0,01). Моллюски, подвергшиеся тепловому стрессу при температуре 28 °C, показали значительно более высокие скорости выделения аммиака через 2, 12 и 72 часа ( P < 0.05 и P < 0,01 соответственно). Скорость выделения аммиака у S. subcrenata при температуре 32 °C была значительно выше, чем у контрольной группы через 2, 24, 48 и 72 ч ( P <0,01).
Звездочки указывают на значимые различия (* P < 0,05; ** P < 0,01) между стрессовой и контрольной группой.
Метаболические профили, проанализированные с помощью ГХ-МСОбразцы мантии subcrenata
и образцы QC показали стабильное время удерживания (рис. S1). Таким образом, TIC может напрямую отражать различия профилей метаболитов между группами. График оценки PCA показан на . Три группы, как правило, были разделены, особенно контрольная группа и группа М-24. Значение R 2 X модели PCA, представляющее объясненную дисперсию для групп, составило 0,484. Все группы находились в пределах эллипса Хотеллинга с доверительной вероятностью 95%, что указывает на то, что анализируемые образцы не содержали выбросов. Счетная диаграмма PCA.
График оценки PCA показан на . Три группы, как правило, были разделены, особенно контрольная группа и группа М-24. Значение R 2 X модели PCA, представляющее объясненную дисперсию для групп, составило 0,484. Все группы находились в пределах эллипса Хотеллинга с доверительной вероятностью 95%, что указывает на то, что анализируемые образцы не содержали выбросов. Счетная диаграмма PCA. КК является образцом контроля качества. М-0 — контрольная группа, а М-2 и М-24 — пробы, взятые через 2 ч и 24 ч соответственно. Эллипс Хотеллинга, указывающий 95% доверительный интервал.
Дальнейшее контролируемое распознавание образов, PLS-DA и OPLS-DA, было выполнено для лучшего объяснения различных метаболических паттернов (). Параметры классификации для моделей PLS-DA и OPLS-DA показаны на , что указывает на надежность моделей.Попарные группы в каждом подучастке были четко разделены на две стороны эллипса Хотеллинга T2, что указывает на то, что обе модели могут выявлять различия между группами.
М-0 — контрольная группа, а М-2 и М-24 — пробы, взятые через 2 и 24 часа соответственно. (A) График оценки PLS-DA группы M-0 и группы M-2, (B) График оценки PLS-DA группы M-0 и группы M-24, (C) График оценки OPLS-DA группы Группа M-0 и группа M-2, (D) График оценки OPLS-DA для группы M-0 и группы M-24.
Таблица 1
Многофакторный анализ профилей метаболитов S. subcrenata после воздействия теплового стресса.Были использованы два главных компонента для модели PCA, два главных компонента для модели PLS-DA и один главный компонент и один ортогональный компонент для модели OPLS-DA.
| Тип модели | 0-2 H | 0-24 H | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
R 2 199 2 R | R 9 2 Y (Cum) | Q 2 (Сперма) | R 2 | Q 2 | R 2 x (Сперма) | R 9179 2 y (CUM) | Q 2 (Сперма) | R 2Q 2 | |||
| PLS-DA | 0. | 3 0.97 | 0,445 | 0,36 0,991 0,841 | ||||||
| OPLS-DA | 0,3 | 0,97 | 0,381 | 0,963 | -0,033 0,468 | 0,999 | 0,833 | 0,993 | -0,003 | |
Идентификация и сравнение метаболитов
Всего 34например, аспарагиновая кислота, глутаминовая кислота и гистидин), органические кислоты (например, креатин, глюконовая кислота, яблочная кислота и щавелевая кислота) и метаболиты, связанные с энергетическим обменом (например, глюкозо-6-фосфат и эритроза). Через 2 часа после теплового стресса 39 метаболитов показали значительные изменения, в том числе 13 метаболитов с подавленной и 26 активизированных метаболитов (таблица S1). Через 24 часа 90 метаболитов показали значительные изменения, в том числе 39 с пониженной и 51 с повышенной регуляцией (таблица S2).
Через 2 часа после теплового стресса 39 метаболитов показали значительные изменения, в том числе 13 метаболитов с подавленной и 26 активизированных метаболитов (таблица S1). Через 24 часа 90 метаболитов показали значительные изменения, в том числе 39 с пониженной и 51 с повышенной регуляцией (таблица S2).
Среди метаболитов, которые показали значительные изменения, относительная концентрация глюкозо-6-фосфата непрерывно снижалась через 2 часа и 24 часа, в отличие от непрерывного увеличения о-фосфорилэтаноламина и таурина ().Молочная кислота была значительно повышена через 2 часа, но снизилась до контрольного уровня через 24 часа; аспарагиновая кислота и глутаминовая кислота значительно снижались через 2 часа, но повышались до контрольного уровня через 24 часа.
Уровни метаболитов метаболитов в мантии S. subcrenata после воздействия 32 °C. (A) Глюкозо-6-фосфат, (B) О-фосфорилэтаноламин, (C) таурин, (D) молочная кислота, (E) аспарагиновая кислота и (F) глутаминовая кислота.
Метаболический путь общих метаболитов
Анализ пути KEGG был выполнен с использованием MetaboAnalyst 3.0 софт. Метаболические пути были идентифицированы в библиотеке Danio rerio KEGG (зебрафиш). Анализ топологии пути был выполнен на основе относительной промежуточности для расчета важных значений. Метаболиты были нанесены на карту 15 путей для образцов, взятых через 2 часа (рис. S2). Из них на путь метаболизма гистидина значительно повлиял тепловой стресс ( P <0,05). Метаболизм D-глютамина, метаболизм аланина, аспартата и глутамата демонстрировал более высокие значения воздействия и также был затронут, хотя существенной разницы не наблюдалось.В общей сложности было получено 15 путей, когда метаболиты были импортированы в KEGG для образцов, взятых через 24 часа, и, по-видимому, ни один путь не был существенно затронут (). Интересно, что пять путей (метаболизм глутатиона, метаболизм гистидина, метаболизм бета-аланина, метаболизм азота, метаболизм аланина, аспартата и глутамата, биосинтез аминоацил-тРНК) показали значительные изменения между 2 и 24 часами (таблица S3).
Таблица 2
Анализ обогащения метаболитов через 2 часа после воздействия 32 °C.
| Путь Р | -log ( Р ) | Влияние | |
|---|---|---|---|
| Гистидин метаболизм | 0,026555 | 3,62 | 0,0 |
| аланин, аспартат и глутамат Метаболизм | 0,071896 | 2,63 | 0,45253 |
| 0 | |||
| Таурин и гипотаурин метаболизм | 0,12386 | 2,09 | 0,2 |
| Азот метаболизм | 0,15645 | 1,86 | 0,0 |
| Аргинин и пролин метаболизм | 0,19022 | 1,66 | 0,09612 |
| Метаболизм никотината и никотинамида | 0,23292 | 1,46 | 0,0 |
| Метаболизм бета-аланина | 6 91. +2616 +2616 | 1,34 | 0,0 |
| сфинголипидов метаболизма | 0,32888 | 1,11 | 0,01504 |
| Пируват метаболизм | 0,34161 | 1,07 | 0,0 |
| бутановой метаболизм | 0,34161 | 1,07 | 0,0 |
| Биосинтез аминоацил-тРНК | 0,35866 | 1,0254 | 0,0 |
| Гликогенез или | 39025 | 0,94097 | 0,0 |
| Глутатион метаболизм | 0,39025 | 0,94097 | 0,02968 |
| порфирина и хлорофилл метаболизм | 0,40186 | 0, | 0,0 |
Таблица 3
Путь анализ обогащения метаболитов через 24 часа после воздействия 32 °C.
| Путь | p | -log ( p ) | Воздействие | |||
|---|---|---|---|---|---|---|
| глиоксилат и дикарбоксилатный метаболизм | 0.18143 | +1,7069 | 0,03704 | |||
| Синтез и деградация кетоновых тел | 0,19888 | 1,615 | 0,0 | |||
| Cyanoamino кислоты метаболизма | 0,23371 | 1,4537 | 0,0 | |||
| бутановой метаболизм | 0,2462 | 1,4016 | 0,0 | |||
| Метаболизм таурина и гипотаурина | 0,26706 | 1,3203 | 0,18552||||
| Биосинтез ненасыщенных жирных кислот | 0,2724 | 1. 3005 3005 | 0,0 | |||
| аланин, аспартат и глутамат метаболизм | 0,27904 | 1,2764 | 0,0 | |||
| Азот метаболизм | 0.32952 | 1.1101 | 0.0 | 0.0 | ||
| 0.38674 | 0.38674 | 0.94999 | 0.16667 | |||
| глицин, серин и треонинский метаболизм | 0.39216 | 0,93608 | 0,0 | |||
| валин, лейцин и изолейцин биосинтез | 0,43916 | 0,82289 | 0,0 | |||
| Гистидин метаболизм | 0,46369 | 0,76853 | 0,2381 | |||
| бета-аланин метаболизм | 0,50963 | 0,67406 | 0,0 | |||
| Метаболизм селеноаминокислот0 | ||||||
| пиримидинов метаболизм | 0,53865 0,61869 0,08825 |
Обсуждения Энергетического обмена
Настоящее исследование показало положительную корреляцию между скоростью потребления кислорода S. subcrenata и температурой окружающая среда. Повышение температуры окружающей среды приведет к увеличению физиологических скоростей и биохимических реакций, таких как активность митохондрий и метаболических ферментов, и других процессов, требующих кислорода и энергии (Иванина и др., 2013). Значительное увеличение скорости потребления кислорода указывало на усиление как аэробного метаболизма, так и потребности в энергии (Morley et al., 2012). Многие исследования показали, что скорость потребления кислорода организмами обычно увеличивается с температурой до достижения пороговой температуры (Shumway, 1982; Yukihira, Lucas & Klumpp, 2000). За пределами этого порога физиологические скорости могут резко снижаться, и конечные продукты анаэробного метаболизма накапливаются (Sommer, Klein & Pörtner, 1997; Zhang et al., 2004). Этот порог часто называют температурой разрыва по Аррениусу (ABT) (Jansen, Hummel & Bonga, 2009). В настоящем исследовании скорость потребления кислорода при 32 °C всегда была выше, чем при других температурах, что позволяет предположить, что ABT для S.
subcrenata и температурой окружающая среда. Повышение температуры окружающей среды приведет к увеличению физиологических скоростей и биохимических реакций, таких как активность митохондрий и метаболических ферментов, и других процессов, требующих кислорода и энергии (Иванина и др., 2013). Значительное увеличение скорости потребления кислорода указывало на усиление как аэробного метаболизма, так и потребности в энергии (Morley et al., 2012). Многие исследования показали, что скорость потребления кислорода организмами обычно увеличивается с температурой до достижения пороговой температуры (Shumway, 1982; Yukihira, Lucas & Klumpp, 2000). За пределами этого порога физиологические скорости могут резко снижаться, и конечные продукты анаэробного метаболизма накапливаются (Sommer, Klein & Pörtner, 1997; Zhang et al., 2004). Этот порог часто называют температурой разрыва по Аррениусу (ABT) (Jansen, Hummel & Bonga, 2009). В настоящем исследовании скорость потребления кислорода при 32 °C всегда была выше, чем при других температурах, что позволяет предположить, что ABT для S. subcrenata выше 32 °C. Однако более высокая смертность (25%) при 32 ° C предполагает, что такой повышенный тепловой стресс может превышать способность к саморегуляции этого вида, несмотря на 6-часовую акклиматизацию моллюсков.
subcrenata выше 32 °C. Однако более высокая смертность (25%) при 32 ° C предполагает, что такой повышенный тепловой стресс может превышать способность к саморегуляции этого вида, несмотря на 6-часовую акклиматизацию моллюсков.
Было подтверждено, что изменения потерь энергии при дыхании из-за теплового стресса влияют на энергетический баланс (González et al., 2002). Производство аммиака является результатом дезаминирования аминокислот и также использовалось для оценки потерь энергии организмами при столкновении со стрессом окружающей среды (Wang et al., 2011; Shin, Chan & Cheung, 2014). Доказательства показали, что аминокислоты могут катаболизироваться после высвобождения из клеток, что приводит к увеличению концентрации аммиака в крови и скорости экскреции аммиака извне (Pierce, 1982; Vitale & Friedl, 1984). Таким образом, скорость экскреции аммиачного азота отражает скорость катаболизма белков (Widdows, 1978).Повышенная скорость экскреции аммиака в настоящем исследовании указывает на то, что аминокислоты могут подвергаться катаболизму, что свидетельствует о повышении потребности в энергии во время теплового стресса.
Метаболический подход в сочетании с многомерным анализом позволил успешно исследовать метаболические изменения в ответ на стресс окружающей среды (Cappello et al., 2013). Многофакторный анализ выявил четкое разделение между контрольной группой и группой с тепловым стрессом, что свидетельствует о наличии значительных метаболических различий в метаболическом профиле.Метаболическое профилирование и функциональный анализ ключевых метаболических путей позволили получить представление о метаболическом статусе как до, так и после теплового стресса (Digilio et al., 2016; Hao et al., 2018). Настоящие данные показали, что более высокие температуры вызвали широкий спектр изменений в профилях метаболитов S. subcrenata . Метаболиты со значительными изменениями и их пути значительно различались у моллюсков, подвергшихся тепловому стрессу в течение 2 и 24 ч, что может быть связано с изменением метаболических субстратов при длительном стрессовом воздействии.
Метаболизм аминокислот
Многие исследования показали, что тепловой стресс может влиять как на энергетический баланс, так и на энергетический гомеостаз водных беспозвоночных (Sokolova et al. , 2012; Han et al., 2013). Как показал анализ обогащения путей, большинство метаболитов, у которых наблюдались значительные изменения, участвовали в метаболизме аминокислот (аланин, аспартат, глутамат, таурин, гистидин и бета-аланин). Свободные аминокислоты составляют большую часть метаболизма морских беспозвоночных (Cappello et al., 2013) и может окисляться для получения энергии в цикле Кребса. Когда устрица ( Crassostrea sikamea ) подверглась воздействию загрязнения металлами, содержание аминокислот, включая треонин, аланин, аргинин, глутамат, бета-аланин, аспартат и глицин, значительно уменьшилось (Ji et al., 2016). Воздействие Cu 2+ может привести к изменению 25 метаболитов, участвующих в реакциях на окислительный стресс и процессах апоптоза у мидии Perna canaliculus (Nguyen et al., 2018a). В настоящем исследовании относительные концентрации как аспарагиновой кислоты, так и глутаминовой кислоты были значительно снижены через 2 часа после теплового стресса, что позволяет предположить, что эти аминокислоты, возможно, были окислены.
, 2012; Han et al., 2013). Как показал анализ обогащения путей, большинство метаболитов, у которых наблюдались значительные изменения, участвовали в метаболизме аминокислот (аланин, аспартат, глутамат, таурин, гистидин и бета-аланин). Свободные аминокислоты составляют большую часть метаболизма морских беспозвоночных (Cappello et al., 2013) и может окисляться для получения энергии в цикле Кребса. Когда устрица ( Crassostrea sikamea ) подверглась воздействию загрязнения металлами, содержание аминокислот, включая треонин, аланин, аргинин, глутамат, бета-аланин, аспартат и глицин, значительно уменьшилось (Ji et al., 2016). Воздействие Cu 2+ может привести к изменению 25 метаболитов, участвующих в реакциях на окислительный стресс и процессах апоптоза у мидии Perna canaliculus (Nguyen et al., 2018a). В настоящем исследовании относительные концентрации как аспарагиновой кислоты, так и глутаминовой кислоты были значительно снижены через 2 часа после теплового стресса, что позволяет предположить, что эти аминокислоты, возможно, были окислены. Это снижение согласуется со значительным увеличением скорости потребления кислорода. Окисление аминокислот для расхода энергии обычно достигается за счет дезаминирования (McVeigh et al., 2006), что также объясняет наблюдаемые значительные изменения скорости экскреции аммиака при 32 °C. Таурин также является осмолитом и играет важную роль в осмотической регуляции (Preston, 1993; Cappello et al., 2013). Повышение уровня таурина свидетельствует о нарушении осмотической регуляции S.subcrenata в условиях теплового стресса, и аналогичные реакции были зарегистрированы для морского ушка Haliotis diversicolor (Lu et al., 2016).
Это снижение согласуется со значительным увеличением скорости потребления кислорода. Окисление аминокислот для расхода энергии обычно достигается за счет дезаминирования (McVeigh et al., 2006), что также объясняет наблюдаемые значительные изменения скорости экскреции аммиака при 32 °C. Таурин также является осмолитом и играет важную роль в осмотической регуляции (Preston, 1993; Cappello et al., 2013). Повышение уровня таурина свидетельствует о нарушении осмотической регуляции S.subcrenata в условиях теплового стресса, и аналогичные реакции были зарегистрированы для морского ушка Haliotis diversicolor (Lu et al., 2016).
Помимо повышенного аэробного метаболизма, в настоящем исследовании также наблюдались изменения анаэробных метаболитов, участвующих в энергетическом метаболизме. Глюкозо-6-фосфат находится в начале двух основных метаболических путей: пути гликолиза и пентозофосфатного пути. Значительное истощение глюкозо-6-фосфата и активация пути гликолиза позволили предположить, что тепловой стресс привел к усилению анаэробного метаболизма S. субкрената . Более того, накопление молочной кислоты и промежуточного продукта цикла Кребса (пировиноградной кислоты) свидетельствовало о том, что цикл Кребса был нарушен переключением на анаэробное дыхание. Аналогичный результат был также обнаружен у мидии P. canaliculus , инфицированной Vibrio sp (Nguyen et al., 2018b; Nguyen & Alfaro, 2019b), и моллюска Crassula aequilatera , подвергшегося термическому стрессу (Alfaro, Nguyen & Mellow, 2019). При температуре окружающей среды, превышающей АБТ, анаэробный метаболизм у лимфы °С.toreuma был усилен опиновым путем для обеспечения энергией (Han, Zhang & Dong, 2017). У нимф веснянок накопление анаэробных метаболитов (лактата, ацетата и аланина) наблюдалось при достижении животными критической температуры (Verberk et al., 2013). Этот переход к частичному анаэробиозу при высокой температуре, вероятно, является компенсацией недостаточной аэробной выработки энергии и может быть объяснен ограниченной способностью поглощения кислорода (Соколова и др.
субкрената . Более того, накопление молочной кислоты и промежуточного продукта цикла Кребса (пировиноградной кислоты) свидетельствовало о том, что цикл Кребса был нарушен переключением на анаэробное дыхание. Аналогичный результат был также обнаружен у мидии P. canaliculus , инфицированной Vibrio sp (Nguyen et al., 2018b; Nguyen & Alfaro, 2019b), и моллюска Crassula aequilatera , подвергшегося термическому стрессу (Alfaro, Nguyen & Mellow, 2019). При температуре окружающей среды, превышающей АБТ, анаэробный метаболизм у лимфы °С.toreuma был усилен опиновым путем для обеспечения энергией (Han, Zhang & Dong, 2017). У нимф веснянок накопление анаэробных метаболитов (лактата, ацетата и аланина) наблюдалось при достижении животными критической температуры (Verberk et al., 2013). Этот переход к частичному анаэробиозу при высокой температуре, вероятно, является компенсацией недостаточной аэробной выработки энергии и может быть объяснен ограниченной способностью поглощения кислорода (Соколова и др. , 2012). У эктотермов, когда отношение поступления кислорода к потребности в кислороде уменьшается и возникает дефицит кислорода, как сердечная, так и дыхательная деятельность были недостаточны для удовлетворения повышенной потребности в кислороде при более высокой температуре (Frederich & Pörtner, 2000; Verberk et al., 2013).
, 2012). У эктотермов, когда отношение поступления кислорода к потребности в кислороде уменьшается и возникает дефицит кислорода, как сердечная, так и дыхательная деятельность были недостаточны для удовлетворения повышенной потребности в кислороде при более высокой температуре (Frederich & Pörtner, 2000; Verberk et al., 2013).
Метаболизм углеводов и метаболизм липидов
В настоящем исследовании значительные изменения фосфоэтаноламина, жирных кислот, цитозина и аденина показали, что метаболизм липидов и нуклеотидов также участвует в реакции на тепловой стресс. Липиды играют как функциональную, так и структурную роль в биологических процессах, таких как обеспечение энергией и поддержание биологических мембран (Lee, Park & Lee, 2018). При окислении жирных кислот образуется ацетил-КоА, который является важным промежуточным метаболитом цикла Кребса (Roznere et al., 2014). Значительное снижение содержания азелаиновой, адипиновой, олеиновой, пальмитиновой и пентадекановой кислот свидетельствует о том, что моллюски использовали запасы энергии липидов для производства ацетил-КоА. Фосфоэтаноламин является промежуточным продуктом метаболизма фосфолипидов. Этаноламин входит в состав фосфатидилэтаноламина (ФЭ), который образует цитомембрану клеток животных (McMaster, Tardi & Choy, 1992). Этаноламин фосфорилируется и вступает в цитидиндифосфатный путь для синтеза PE (Cheng et al., 2012). Сообщалось, что изменения температуры могут приводить к ремоделированию липидов мембран у голубой мидии Mytilus edulis и устрицы C. virginica (Pernet et al., 2007, 2008). Настоящее исследование обнаружило значительную активацию фосфоэтаноламина. Это не согласуется с повышением уровня таурина, указывая на то, что проницаемость мембраны может зависеть от воздействия теплового стресса. Внутриклеточные концентрации адениновых нуклеотидов были предложены в качестве индикаторов стресса у водных организмов (Vetter, Hwang & Hodson, 1986).В настоящем исследовании концентрации как аденина, так и цитозина значительно увеличились через 2 часа после воздействия 32 °C, после чего через 24 часа последовало увеличение аденозина и цитидинмонофосфата, что указывает на усиленный синтез нуклеотидов.
Фосфоэтаноламин является промежуточным продуктом метаболизма фосфолипидов. Этаноламин входит в состав фосфатидилэтаноламина (ФЭ), который образует цитомембрану клеток животных (McMaster, Tardi & Choy, 1992). Этаноламин фосфорилируется и вступает в цитидиндифосфатный путь для синтеза PE (Cheng et al., 2012). Сообщалось, что изменения температуры могут приводить к ремоделированию липидов мембран у голубой мидии Mytilus edulis и устрицы C. virginica (Pernet et al., 2007, 2008). Настоящее исследование обнаружило значительную активацию фосфоэтаноламина. Это не согласуется с повышением уровня таурина, указывая на то, что проницаемость мембраны может зависеть от воздействия теплового стресса. Внутриклеточные концентрации адениновых нуклеотидов были предложены в качестве индикаторов стресса у водных организмов (Vetter, Hwang & Hodson, 1986).В настоящем исследовании концентрации как аденина, так и цитозина значительно увеличились через 2 часа после воздействия 32 °C, после чего через 24 часа последовало увеличение аденозина и цитидинмонофосфата, что указывает на усиленный синтез нуклеотидов. Однако значительных изменений в уровнях аденозин-5′-монофосфата (АМФ) не наблюдалось. Концентрация тимина значительно увеличилась через 24 часа, в то время как концентрация тимидина значительно снизилась, что позволяет предположить, что метаболизм нуклеотидов во время теплового стресса требует дальнейшего изучения.
Однако значительных изменений в уровнях аденозин-5′-монофосфата (АМФ) не наблюдалось. Концентрация тимина значительно увеличилась через 24 часа, в то время как концентрация тимидина значительно снизилась, что позволяет предположить, что метаболизм нуклеотидов во время теплового стресса требует дальнейшего изучения.
Выводы
Таким образом, потребление кислорода и скорость выделения аммиака были определены во время стресса, вызванного различными повышенными температурами у S. subcrenata . Для оценки изменений метаболитов при 32 °C был применен подход к метаболомике на основе ГХ/МС. Результаты показали, что моллюски увеличивали скорость метаболизма при повышенной температуре, а смертность наблюдалась при тепловом стрессе. Метаболитный и функциональный анализы показали, что тепловой стресс вызывает нарушения энергетического обмена, осмотической регуляции, метаболизма аминокислот, метаболизма углеводов и метаболизма липидов посредством различных метаболических путей. Настоящее исследование вносит важный вклад в понимание воздействия теплового стресса на моллюска S. subcrenata и проясняет взаимосвязь между реакцией всего организма и динамикой молекулярного метаболизма. Чтобы лучше понять физиологическую реакцию двустворчатых моллюсков на стрессы окружающей среды, в будущих исследованиях может быть принята интеграция различных омических подходов, включая транскриптомику, протеомику и метаболомику.
Настоящее исследование вносит важный вклад в понимание воздействия теплового стресса на моллюска S. subcrenata и проясняет взаимосвязь между реакцией всего организма и динамикой молекулярного метаболизма. Чтобы лучше понять физиологическую реакцию двустворчатых моллюсков на стрессы окружающей среды, в будущих исследованиях может быть принята интеграция различных омических подходов, включая транскриптомику, протеомику и метаболомику.
Дополнительная информация
Дополнительная информация 1
GC-MS TIC образцов мантии.(А): контроль (Б): 2 ч (С): 24 ч. Ордината показывает относительное массовое содержание, а абсцисса показывает время удерживания.
Дополнительная информация 2
Анализ обогащения метаболитов после воздействия теплового стресса.А: 2 часа, В: 24 часа.
Дополнительная информация 3
Сводка метаболитов со значительными изменениями в мантии S. subcrenata через 2 часа после воздействия 32 °C.
Дополнительная информация 4
Сводка метаболитов со значительными изменениями в мантии S.subcrenata через 24 часа после воздействия температуры 32 °C.Дополнительная информация 5
Потребление кислорода и скорость выделения аммиака у S. subcrenata после воздействия различных температур.Дополнительная информация 6
Анализ обогащения метаболитов между 2 и 24 часами после воздействия 32 °C.Дополнительная информация 7
Пути обогащения между 0–2 ч, 0–24 ч и 2–24 ч после воздействия 32 °C.Дополнительная информация 8
Матрица данных метаболомного анализа.Дополнительная информация 9
Метаболиты со значительными изменениями в мантии S. subcrenata .Благодарности
Мы очень благодарны г-же Вэньчао Лю и г-ну Пейбо Бао за помощь в проведении лабораторных измерений.
Заявление о финансировании
Эта работа была поддержана Специальным фондом агронаучных исследований в общественных интересах Китая (201303047), Шанхайским фондом естественных наук (18ZR1450000) и Национальным фондом естественных наук Китая (41576167) . Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Дополнительная информация и заявления
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Вклад авторов
Ячжоу Цзян задумал и спроектировал эксперименты, провел эксперименты, подготовил рисунки и/или таблицы, написал или просмотрел черновики статьи и утвердил окончательный вариант.
Хайфэн Цзяо проводил эксперименты, составлял или рецензировал проекты статьи и утверждал окончательный вариант.
Peng Sun подготовила рисунки и/или таблицы и утвердила окончательный вариант.
Фэй Инь проанализировала данные, написала или проверила черновики статьи и утвердила окончательный вариант.
Баоцзюнь Тан задумал и разработал эксперименты, провел эксперименты, проанализировал данные, подготовил рисунки и/или таблицы, написал или просмотрел черновики статьи и утвердил окончательный вариант.
Доступность данных
Следующая информация была предоставлена относительно доступности данных:
Необработанные измерения скорости метаболизма, матрица данных анализа метаболомики, метаболиты со значительными изменениями, анализ обогащения пути метаболитов между 2 часами и 24 часами, и все пути, обогащенные после воздействия 32 ° C, доступны в дополнительных файлах.
Ссылки
Alfaro, Nguyen & Mellow (2019) Alfaro AC, Nguyen TV, Mellow D.Метаболический подход к оценке влияния условий хранения на метаболические процессы новозеландского моллюска ( Crassula aequilatera ) в аквакультуре. 2019; 498:315–321. doi: 10.1016/j.aquaculture.2018.08.065. [CrossRef] [Google Scholar]Alfaro & Young (2018) Alfaro AC, Young T. Демонстрация применения метаболомики в аквакультуре: обзор. Обзоры в аквакультуре. 2018;10(1):135–152. doi: 10.1111/raq.12152. [CrossRef] [Google Scholar] Anestis et al. (2007) Анестис А., Лазу А., Пёртнер Х.О., Михаэлидис Б.Поведенческие, метаболические и молекулярные реакции на стресс морского двустворчатого моллюска Mytilus galloprovincialis во время длительной акклиматизации при повышении температуры окружающей среды. Американский журнал физиологии-регуляторной, интегративной и сравнительной физиологии. 2007; 293(2):R911–R921. doi: 10.1152/ajpregu.00124.2007. [PubMed] [CrossRef] [Google Scholar] Artigaud et al. (2015) Artigaud S, Lacroix C, Richard J, Flye-Sainte-Marie J, Bargelloni L, Pichereau V. Протеомные реакции на гипоксию при различных температурах у большого гребешка ( Pecten maximus ) PeerJ.2015;3(3):e871. doi: 10.7717/peerj.871. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Artigaud et al. (2014) Артиго С., Торн МАС, Ричард Дж., Лаво Р., Жан Ф., Флай-Сент-Мари Дж., Пек Л.С., Пишеро В., Кларк М.С. Глубокое секвенирование транскриптома мантии большого гребешка Pecten maximus . Морская геномика. 2014; 15:3–4. doi: 10.1016/j.margen.2014.03.006. [PubMed] [CrossRef] [Google Scholar]Cappello et al. (2013) Каппелло Т., Мосери А., Корсаро С., Майсано М., Паррино В., Паро Г.Л., Джузеппе Л.П., Джузеппе М., Сальваторе Ф.Воздействие загрязнения окружающей среды на мидий, содержащихся в садках Mytilus galloprovincialis , с использованием метаболомики на основе ЯМР.
Американский журнал физиологии-регуляторной, интегративной и сравнительной физиологии. 2007; 293(2):R911–R921. doi: 10.1152/ajpregu.00124.2007. [PubMed] [CrossRef] [Google Scholar] Artigaud et al. (2015) Artigaud S, Lacroix C, Richard J, Flye-Sainte-Marie J, Bargelloni L, Pichereau V. Протеомные реакции на гипоксию при различных температурах у большого гребешка ( Pecten maximus ) PeerJ.2015;3(3):e871. doi: 10.7717/peerj.871. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Artigaud et al. (2014) Артиго С., Торн МАС, Ричард Дж., Лаво Р., Жан Ф., Флай-Сент-Мари Дж., Пек Л.С., Пишеро В., Кларк М.С. Глубокое секвенирование транскриптома мантии большого гребешка Pecten maximus . Морская геномика. 2014; 15:3–4. doi: 10.1016/j.margen.2014.03.006. [PubMed] [CrossRef] [Google Scholar]Cappello et al. (2013) Каппелло Т., Мосери А., Корсаро С., Майсано М., Паррино В., Паро Г.Л., Джузеппе Л.П., Джузеппе М., Сальваторе Ф.Воздействие загрязнения окружающей среды на мидий, содержащихся в садках Mytilus galloprovincialis , с использованием метаболомики на основе ЯМР. Бюллетень о загрязнении морской среды. 2013;77(1–2):132–139. doi: 10.1016/j.marpolbul.2013.10.019. [PubMed] [CrossRef] [Google Scholar] Casas et al. (2018) Casas SM, Filgueira R, Lavaud R, Comeau LA, La Peyre MK, La Peyre JF. Комбинированное воздействие температуры и солености на физиологию двух географически удаленных восточных популяций устриц. Журнал экспериментальной морской биологии и экологии.2018; 506: 82–90. doi: 10.1016/j.jembe.2018.06.001. [CrossRef] [Google Scholar] Чен и др. (2015) Chen S, Zhang C, Xiong Y, Tian X, Liu C, Jeevithan E, Wu W. Метаболическое исследование на основе ГХ-МС морского гребешка ( Chlamys farreri ) во время полубезводного сохранения живых организмов. Инновационная пищевая наука и новые технологии. 2015; 31:185–195. doi: 10.1016/j.ifset.2015.07.003. [CrossRef] [Google Scholar] Cheng et al. (2012) Cheng J-S, Niu Y-H, Lu S-H, Yuan Y-J. Анализ метаболизма показывает, что этаноламин является потенциальным маркером улучшения накопления липидов модельными фотосинтезирующими организмами.
Бюллетень о загрязнении морской среды. 2013;77(1–2):132–139. doi: 10.1016/j.marpolbul.2013.10.019. [PubMed] [CrossRef] [Google Scholar] Casas et al. (2018) Casas SM, Filgueira R, Lavaud R, Comeau LA, La Peyre MK, La Peyre JF. Комбинированное воздействие температуры и солености на физиологию двух географически удаленных восточных популяций устриц. Журнал экспериментальной морской биологии и экологии.2018; 506: 82–90. doi: 10.1016/j.jembe.2018.06.001. [CrossRef] [Google Scholar] Чен и др. (2015) Chen S, Zhang C, Xiong Y, Tian X, Liu C, Jeevithan E, Wu W. Метаболическое исследование на основе ГХ-МС морского гребешка ( Chlamys farreri ) во время полубезводного сохранения живых организмов. Инновационная пищевая наука и новые технологии. 2015; 31:185–195. doi: 10.1016/j.ifset.2015.07.003. [CrossRef] [Google Scholar] Cheng et al. (2012) Cheng J-S, Niu Y-H, Lu S-H, Yuan Y-J. Анализ метаболизма показывает, что этаноламин является потенциальным маркером улучшения накопления липидов модельными фотосинтезирующими организмами. Журнал химической технологии и биотехнологии. 2012;87(10):1409–1418. doi: 10.1002/jctb.3759. [CrossRef] [Google Scholar] Cheung & Lam (1995) Cheung SG, Lam SW. Влияние солености, температуры и акклиматизации на потребление кислорода Nassarius festivus (Powys, 1835) (Gastropoda: Nassariidae) Сравнительная биохимия и физиология Часть A: Физиология. 1995;111(4):625–631. doi: 10.1016/0300-9629(95)00051-8. [CrossRef] [Google Scholar] Давенпорт и Давенпорт (2005) Давенпорт Дж., Давенпорт Дж.Л.Влияние высоты берега, воздействия волн и географического расстояния на ширину термальной ниши приливной фауны. Серия «Прогресс морской экологии». 2005;292(1):41–50. doi: 10.3354/meps2
Журнал химической технологии и биотехнологии. 2012;87(10):1409–1418. doi: 10.1002/jctb.3759. [CrossRef] [Google Scholar] Cheung & Lam (1995) Cheung SG, Lam SW. Влияние солености, температуры и акклиматизации на потребление кислорода Nassarius festivus (Powys, 1835) (Gastropoda: Nassariidae) Сравнительная биохимия и физиология Часть A: Физиология. 1995;111(4):625–631. doi: 10.1016/0300-9629(95)00051-8. [CrossRef] [Google Scholar] Давенпорт и Давенпорт (2005) Давенпорт Дж., Давенпорт Дж.Л.Влияние высоты берега, воздействия волн и географического расстояния на ширину термальной ниши приливной фауны. Серия «Прогресс морской экологии». 2005;292(1):41–50. doi: 10.3354/meps2 Сравнительная биохимия и физиология. Часть C: Токсикология и фармакология.2016; 183–184: 61–71. doi: 10.1016/j.cbpc.2016.02.003. [PubMed] [CrossRef] [Google Scholar] Дауд и Сомеро (2013) Дауд В.В., Сомеро Г.Н. Поведение и выживание Mytilus congeners после эпизодов повышенной температуры тела в воздухе и морской воде. Журнал экспериментальной биологии. 2013;216(3):502–514. doi: 10.1242/jeb.076620. [PubMed] [CrossRef] [Google Scholar] Ellis et al. (2014) Эллис Р.П., Спайсер Дж.И., Бирн Дж.Дж., Соммер У., Виант М.Р., Уайт Д.А., Виддикомб С. 1 H ЯМР-метаболомика показывает контрастную реакцию самцов и самок мидий, подвергшихся воздействию пониженного pH морской воды, повышенной температуры и патогена. .Экологические науки и технологии. 2014;48(12):7044–7052. doi: 10.1021/es501601w. [PubMed] [CrossRef] [Google Scholar] Ezgeta-Balić et al. (2011) Эзгета-Балич Д., Ринальди А., Пехарда М., Прусина И., Монтальто В., Никета Н., Сара Г. Энергетический баланс сублиторального двустворчатого моллюска Modiolus barbatus (Mollusca) при разных температурах.
Сравнительная биохимия и физиология. Часть C: Токсикология и фармакология.2016; 183–184: 61–71. doi: 10.1016/j.cbpc.2016.02.003. [PubMed] [CrossRef] [Google Scholar] Дауд и Сомеро (2013) Дауд В.В., Сомеро Г.Н. Поведение и выживание Mytilus congeners после эпизодов повышенной температуры тела в воздухе и морской воде. Журнал экспериментальной биологии. 2013;216(3):502–514. doi: 10.1242/jeb.076620. [PubMed] [CrossRef] [Google Scholar] Ellis et al. (2014) Эллис Р.П., Спайсер Дж.И., Бирн Дж.Дж., Соммер У., Виант М.Р., Уайт Д.А., Виддикомб С. 1 H ЯМР-метаболомика показывает контрастную реакцию самцов и самок мидий, подвергшихся воздействию пониженного pH морской воды, повышенной температуры и патогена. .Экологические науки и технологии. 2014;48(12):7044–7052. doi: 10.1021/es501601w. [PubMed] [CrossRef] [Google Scholar] Ezgeta-Balić et al. (2011) Эзгета-Балич Д., Ринальди А., Пехарда М., Прусина И., Монтальто В., Никета Н., Сара Г. Энергетический баланс сублиторального двустворчатого моллюска Modiolus barbatus (Mollusca) при разных температурах. Морские экологические исследования. 2011;71(1):79–85. doi: 10.1016/j.marenvres.2010.10.005. [PubMed] [CrossRef] [Google Scholar] Frederich & Pörtner (2000) Frederich M, Pörtner HO.Кислородное ограничение термоустойчивости, определяемое сердечной и вентиляционной работой у краба-паука, Maja squinado . Американский журнал физиологии-регуляторной, интегративной и сравнительной физиологии. 2000;279(5):R1531–R1538. doi: 10.1152/ajpregu.2000.279.5.R1531. [PubMed] [CrossRef] [Google Scholar] Фриск, Штеффенсен и Сков (2013) Фриск М., Штеффенсен Дж. Ф., Сков П. В. Влияние температуры на специфическое динамическое действие и выделение аммиака у судака ( Sander lucioperca ) Аквакультура.2013; 404-405: 65–70. doi: 10.1016/j.aquaculture.2013.04.005. [CrossRef] [Google Scholar] Гонсалес и др. (2002) Гонсалес М.Л., Лопес Д.А., Перес М.С., Кастро Х.М. Влияние температуры на размах роста молоди гребешка Argopecten purpuratus (Lamark, 1819) Aquaculture International. 2002;10(4):339–348.
Морские экологические исследования. 2011;71(1):79–85. doi: 10.1016/j.marenvres.2010.10.005. [PubMed] [CrossRef] [Google Scholar] Frederich & Pörtner (2000) Frederich M, Pörtner HO.Кислородное ограничение термоустойчивости, определяемое сердечной и вентиляционной работой у краба-паука, Maja squinado . Американский журнал физиологии-регуляторной, интегративной и сравнительной физиологии. 2000;279(5):R1531–R1538. doi: 10.1152/ajpregu.2000.279.5.R1531. [PubMed] [CrossRef] [Google Scholar] Фриск, Штеффенсен и Сков (2013) Фриск М., Штеффенсен Дж. Ф., Сков П. В. Влияние температуры на специфическое динамическое действие и выделение аммиака у судака ( Sander lucioperca ) Аквакультура.2013; 404-405: 65–70. doi: 10.1016/j.aquaculture.2013.04.005. [CrossRef] [Google Scholar] Гонсалес и др. (2002) Гонсалес М.Л., Лопес Д.А., Перес М.С., Кастро Х.М. Влияние температуры на размах роста молоди гребешка Argopecten purpuratus (Lamark, 1819) Aquaculture International. 2002;10(4):339–348. doi: 10.1023/A:102242
doi: 10.1023/A:102242 Журнал экспериментальной биологии. 2013;216(17):3273–3282. doi: 10.1242/jeb.084269. [PubMed] [CrossRef] [Google Scholar] Hansen et al. (2006) Хансен Дж., Сато М., Руди Р., Ло К., Леа Д.В., Медина-Элизаде М. Глобальное изменение температуры. Труды Национальной академии наук США. 2006;103(39):14288–14293. doi: 10.1073/pnas.06062. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Hao et al. (2018) Hao R, Wang Z, Yang C, Deng Y, Zheng Z, Wang Q, Du X. Метаболические реакции молоди жемчужной устрицы Pinctada maxima на различные показатели роста.Аквакультура. 2018; 491: 258–265. doi: 10.1016/j.aquaculture.2018.03.050. [CrossRef] [Google Scholar] Иванина и др. (2013) Иванина А.В., Дикинсон Г.Х., Мату О.Б., Багве Р., Дикинсон А., Бениаш Э., Соколова ИМ. Интерактивное воздействие повышенной температуры и уровня CO2 на энергетический обмен и биоминерализацию морских двустворчатых моллюсков Crassostrea virginica и Mercenaria mercenaria . Сравнительная биохимия и физиология, часть A: молекулярная и интегративная физиология.
Журнал экспериментальной биологии. 2013;216(17):3273–3282. doi: 10.1242/jeb.084269. [PubMed] [CrossRef] [Google Scholar] Hansen et al. (2006) Хансен Дж., Сато М., Руди Р., Ло К., Леа Д.В., Медина-Элизаде М. Глобальное изменение температуры. Труды Национальной академии наук США. 2006;103(39):14288–14293. doi: 10.1073/pnas.06062. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Hao et al. (2018) Hao R, Wang Z, Yang C, Deng Y, Zheng Z, Wang Q, Du X. Метаболические реакции молоди жемчужной устрицы Pinctada maxima на различные показатели роста.Аквакультура. 2018; 491: 258–265. doi: 10.1016/j.aquaculture.2018.03.050. [CrossRef] [Google Scholar] Иванина и др. (2013) Иванина А.В., Дикинсон Г.Х., Мату О.Б., Багве Р., Дикинсон А., Бениаш Э., Соколова ИМ. Интерактивное воздействие повышенной температуры и уровня CO2 на энергетический обмен и биоминерализацию морских двустворчатых моллюсков Crassostrea virginica и Mercenaria mercenaria . Сравнительная биохимия и физиология, часть A: молекулярная и интегративная физиология. 2013;166(1):101–111.doi: 10.1016/j.cbpa.2013.05.016. [PubMed] [CrossRef] [Google Scholar] Jansen, Hummel & Bonga (2009) Jansen JM, Hummel H, Bonga SW. Дыхательная способность морских мидий ( Mytilus galloprovincialis ) в зависимости от порога высокой температуры. Сравнительная биохимия и физиология, часть A: молекулярная и интегративная физиология. 2009;153(4):399–402. doi: 10.1016/j.cbpa.2009.03.013. [PubMed] [CrossRef] [Google Scholar] Ji et al. (2016) Ji C, Li F, Wang Q, Zhao J, Sun Z, Wu H.Комплексное протеомное и метаболическое исследование гендерно-специфических реакций мидий Mytilus galloprovincialis на тетрабромбисфенол А (ТББФА) Chemosphere. 2016; 144: 527–539. doi: 10.1016/j.chemosphere.2015.08.052. [PubMed] [CrossRef] [Google Scholar] Jin, Ahn & Je (2018) Jin JE, Ahn CB, Je JY. Очистка и характеристика антиоксидантных пептидов из ферментативно гидролизованной оболочки ковчега ( Scapharca subcrenata ) Процесс биохимии. 2018;72:170–176. дои: 10.1016/j.
2013;166(1):101–111.doi: 10.1016/j.cbpa.2013.05.016. [PubMed] [CrossRef] [Google Scholar] Jansen, Hummel & Bonga (2009) Jansen JM, Hummel H, Bonga SW. Дыхательная способность морских мидий ( Mytilus galloprovincialis ) в зависимости от порога высокой температуры. Сравнительная биохимия и физиология, часть A: молекулярная и интегративная физиология. 2009;153(4):399–402. doi: 10.1016/j.cbpa.2009.03.013. [PubMed] [CrossRef] [Google Scholar] Ji et al. (2016) Ji C, Li F, Wang Q, Zhao J, Sun Z, Wu H.Комплексное протеомное и метаболическое исследование гендерно-специфических реакций мидий Mytilus galloprovincialis на тетрабромбисфенол А (ТББФА) Chemosphere. 2016; 144: 527–539. doi: 10.1016/j.chemosphere.2015.08.052. [PubMed] [CrossRef] [Google Scholar] Jin, Ahn & Je (2018) Jin JE, Ahn CB, Je JY. Очистка и характеристика антиоксидантных пептидов из ферментативно гидролизованной оболочки ковчега ( Scapharca subcrenata ) Процесс биохимии. 2018;72:170–176. дои: 10.1016/j. procbio.2018.06.001. [CrossRef] [Google Scholar] Juárez et al. (2018) Хуарес О.Э., Крус Ф.Л., Лейва-Валенсия И., Лопес-Ландавери Э., Гарсия-Эскивель З., Диас Ф., Ре-Араухо Д., Вадопалас Б., Галиндо-Санчес К.Э. Транскриптомный и метаболический ответ на хроническое и острое термическое воздействие на молодь моллюсков геоутки Panopea globosa . Морская геномика. 2018; 42:1–13. doi: 10.1016/j.margen.2018.09.003. [PubMed] [CrossRef] [Google Scholar] Lagerspetz (2006) Lagerspetz KYH. Что такое термическая акклиматизация? Журнал тепловой биологии.2006;31(4):332–336. doi: 10.1016/j.jtherbio.2006.01.003. [CrossRef] [Google Scholar] Lee, Park & Lee (2018) Lee MC, Park JC, Lee JS. Влияние стрессоров окружающей среды на метаболизм липидов у водных беспозвоночных. Водная токсикология. 2018;200:83–92. doi: 10.1016/j.aquatox.2018.04.016. [PubMed] [CrossRef] [Google Scholar] Lim et al. (2016) Lim HJ, Kim BM, Hwang IJ, Lee JS, Choi IY, Kim YJ, Rhee JS. Термический стресс вызывает отчетливый профиль транскриптома у тихоокеанской устрицы Crassostrea gigas .
procbio.2018.06.001. [CrossRef] [Google Scholar] Juárez et al. (2018) Хуарес О.Э., Крус Ф.Л., Лейва-Валенсия И., Лопес-Ландавери Э., Гарсия-Эскивель З., Диас Ф., Ре-Араухо Д., Вадопалас Б., Галиндо-Санчес К.Э. Транскриптомный и метаболический ответ на хроническое и острое термическое воздействие на молодь моллюсков геоутки Panopea globosa . Морская геномика. 2018; 42:1–13. doi: 10.1016/j.margen.2018.09.003. [PubMed] [CrossRef] [Google Scholar] Lagerspetz (2006) Lagerspetz KYH. Что такое термическая акклиматизация? Журнал тепловой биологии.2006;31(4):332–336. doi: 10.1016/j.jtherbio.2006.01.003. [CrossRef] [Google Scholar] Lee, Park & Lee (2018) Lee MC, Park JC, Lee JS. Влияние стрессоров окружающей среды на метаболизм липидов у водных беспозвоночных. Водная токсикология. 2018;200:83–92. doi: 10.1016/j.aquatox.2018.04.016. [PubMed] [CrossRef] [Google Scholar] Lim et al. (2016) Lim HJ, Kim BM, Hwang IJ, Lee JS, Choi IY, Kim YJ, Rhee JS. Термический стресс вызывает отчетливый профиль транскриптома у тихоокеанской устрицы Crassostrea gigas . Сравнительная биохимия и физиология. Часть D: Геномика и протеомика. 2016;19:62–70. doi: 10.1016/j.cbd.2016.06.006. [PubMed] [CrossRef] [Google Scholar] Lu et al. (2016) Lu J, Shi Y, Wang S, Chen H, Cai S, Feng J. Метаболический анализ на основе ЯМР Haliotis diversicolor , подвергшихся тепловым и гипоксическим стрессам. Наука о полной окружающей среде. 2016; 545–546: 280–288. doi: 10.1016/j.scitotenv.2015.12.071. [PubMed] [CrossRef] [Google Scholar]McMaster, Tardi & Choy (1992) McMaster CR, Tardi PG, Choy PC.Модуляция биосинтеза фосфатидилэтаноламина экзогенным этаноламином и аналогами в сердце хомяка. Молекулярная и клеточная биохимия. 1992;116(1–2):69–73. doi: 10.1007/BF01270571. [PubMed] [CrossRef] [Google Scholar]McVeigh et al. (2006) Маквей А., Мур М., Аллен Дж. И., Дайк П. Лизосомальные реакции на пищевой и контаминантный стресс в пищеварительных клетках гепатопанкреатической мидии: исследование моделирования. Морские экологические исследования. 2006; 62 (Приложение 1): S433–S438.
Сравнительная биохимия и физиология. Часть D: Геномика и протеомика. 2016;19:62–70. doi: 10.1016/j.cbd.2016.06.006. [PubMed] [CrossRef] [Google Scholar] Lu et al. (2016) Lu J, Shi Y, Wang S, Chen H, Cai S, Feng J. Метаболический анализ на основе ЯМР Haliotis diversicolor , подвергшихся тепловым и гипоксическим стрессам. Наука о полной окружающей среде. 2016; 545–546: 280–288. doi: 10.1016/j.scitotenv.2015.12.071. [PubMed] [CrossRef] [Google Scholar]McMaster, Tardi & Choy (1992) McMaster CR, Tardi PG, Choy PC.Модуляция биосинтеза фосфатидилэтаноламина экзогенным этаноламином и аналогами в сердце хомяка. Молекулярная и клеточная биохимия. 1992;116(1–2):69–73. doi: 10.1007/BF01270571. [PubMed] [CrossRef] [Google Scholar]McVeigh et al. (2006) Маквей А., Мур М., Аллен Дж. И., Дайк П. Лизосомальные реакции на пищевой и контаминантный стресс в пищеварительных клетках гепатопанкреатической мидии: исследование моделирования. Морские экологические исследования. 2006; 62 (Приложение 1): S433–S438. doi: 10.1016/j.marenvres.2006.04.021. [PubMed] [CrossRef] [Google Scholar] Мишра, Гонг и Келли (2017) Мишра П., Гонг З., Келли Б.К. Оценка биологических эффектов флуоксетина на развивающихся эмбрионах рыбок данио с использованием метаболомики на основе газовой хроматографии и масс-спектрометрии. Хемосфера. 2017; 188:157–167. doi: 10.1016/j.chemosphere.2017.08.149. [PubMed] [CrossRef] [Google Scholar] Morley et al. (2012) Морли С.А., Хирс Т., Торн М.А.С., Пёртнер Х.О., Пек Л.С. Физиологическая пластичность, долговременная устойчивость или акклиматизация к температуре у антарктического двустворчатого моллюска Laternula elliptica .Сравнительная биохимия и физиология, часть A: молекулярная и интегративная физиология. 2012;162(1):16–21. doi: 10.1016/j.cbpa.2012.01.009. [PubMed] [CrossRef] [Google Scholar] Nakamura (2005) Nakamura Y. Подкормка оболочки ковчега Scapharca subcrenata как функция экологических и биологических переменных. Наука о рыболовстве. 2005;71(4):875–883.
doi: 10.1016/j.marenvres.2006.04.021. [PubMed] [CrossRef] [Google Scholar] Мишра, Гонг и Келли (2017) Мишра П., Гонг З., Келли Б.К. Оценка биологических эффектов флуоксетина на развивающихся эмбрионах рыбок данио с использованием метаболомики на основе газовой хроматографии и масс-спектрометрии. Хемосфера. 2017; 188:157–167. doi: 10.1016/j.chemosphere.2017.08.149. [PubMed] [CrossRef] [Google Scholar] Morley et al. (2012) Морли С.А., Хирс Т., Торн М.А.С., Пёртнер Х.О., Пек Л.С. Физиологическая пластичность, долговременная устойчивость или акклиматизация к температуре у антарктического двустворчатого моллюска Laternula elliptica .Сравнительная биохимия и физиология, часть A: молекулярная и интегративная физиология. 2012;162(1):16–21. doi: 10.1016/j.cbpa.2012.01.009. [PubMed] [CrossRef] [Google Scholar] Nakamura (2005) Nakamura Y. Подкормка оболочки ковчега Scapharca subcrenata как функция экологических и биологических переменных. Наука о рыболовстве. 2005;71(4):875–883. doi: 10.1111/j.1444-2906.2005.01040.x. [CrossRef] [Google Scholar] Нгуен и Альфаро (2019a) Нгуен ТВ, Альфаро AC. Применение омиков для исследования реакции гемоцитов двустворчатых моллюсков на патогенные инфекции и стресс окружающей среды.Аквакультура. 2019a doi: 10.1016/j.aquaculture.2019.734488. Epub перед печатью, 13 сентября 2019 г. [CrossRef] [Google Scholar] Нгуен и Альфаро (2019b) Нгуен ТВ, Альфаро AC. Целевая метаболомика для исследования антимикробной активности итаконовой кислоты у морских моллюсков. Метаболомика. 2019b;15(7):97. doi: 10.1007/s11306-019-1556-8. [PubMed] [CrossRef] [Google Scholar] Nguyen et al. (2018a) Нгуен Т.В., Альфаро А.С., Мериен Ф., Лулийва Р., Янг Т. Медь-индуцированная иммуномодуляция в гемоцитах мидий ( Perna canaliculus ).Металломика. 2018а; 10(7):965–978. doi: 10.1039/C8MT00092A. [PubMed] [CrossRef] [Google Scholar] Nguyen et al. (2018b) Нгуен Т.В., Альфаро А.С., Мериен Ф., Янг Т., Грандиоза Р. Метаболические и иммунологические реакции самцов и самок новозеландских мидий Greenshell™ ( Perna canaliculus ), инфицированных Vibrio sp. Журнал патологии беспозвоночных. 2018b;157:80–89. doi: 10.1016/j.jip.2018.08.008. [PubMed] [CrossRef] [Google Scholar] Nguyen et al. (2019) Нгуен ТВ, Альфаро АС, Янг Т, Мериен Ф.Тканеспецифические иммунные ответы на Vibrio sp. инфекция у мидий ( Perna canaliculus ): метаболомический подход. Аквакультура. 2019;500:118–125. doi: 10.1016/j.aquaculture.2018.09.061. [CrossRef] [Google Scholar] Нгуен и др. (2018c) Нгуен Т.В., Альфаро А.С., Янг Т., Рави С., Мериен Ф. Метаболомическое исследование иммунных реакций новозеландских мидий greenshell™ ( Perna canaliculus ), инфицированных патогенными Vibrio sp. Морская биотехнология. 2018c;20(3):396–409.doi: 10.1007/s10126-018-9804-x. [PubMed] [CrossRef] [Google Scholar]Nie et al. (2017) Ни Х.Т., Лю Л.Х., Хо З.М., Чен П., Дин Дж.Ф., Ян Ф., Ян XW. Реакция экспрессии гена HSP70 на температурный и солевой стресс у диких и культивируемых манильского моллюска Ruditapes philippinarum . Аквакультура. 2017; 470:149–156. doi: 10.1016/j.aquaculture.2016.12.016. [CrossRef] [Google Scholar]Pernet et al. (2007) Pernet F, Tremblay R, Comeau L, Guderley H. Температурная адаптация у двух видов двустворчатых моллюсков из разных тепловых мест обитания: энергетика и ремоделирование мембранных липидов.Журнал экспериментальной биологии. 2007;210(17):2999–3014. doi: 10.1242/jeb.006007. [PubMed] [CrossRef] [Google Scholar] Pernet et al. (2008) Pernet F, Tremblay R, Redjah I, Sevigny JM, Gionet C. Физиологические и биохимические признаки коррелируют с различиями в скорости роста и температурной адаптации среди групп восточной устрицы Crassostrea virginica . Журнал экспериментальной биологии. 2008;211(6):969–977. doi: 10.1242/jeb.014639. [PubMed] [CrossRef] [Google Scholar] Пирс (1982) Пирс С.Механизмы контроля объема клеток беспозвоночных: скоординированное использование внутриклеточных аминокислот и неорганических ионов в качестве осмотического раствора. Биологический вестник. 1982;163(3):405–419. дои: 10.2307/1541452. [CrossRef] [Google Scholar] Престон (1993) Престон Р.Л. Транспорт аминокислот морскими беспозвоночными. Журнал экспериментальной зоологии. 1993;265(4):410–421. doi: 10.1002/jez.1402650410. [CrossRef] [Google Scholar] Pörtner (2010) Pörtner HO. Ограничение кислорода и мощности термоустойчивости: amatrix для интеграции стрессовых воздействий, связанных с климатом, в морских экосистемах.Журнал экспериментальной биологии. 2010;213(6):881–893. doi: 10.1242/jeb.037523. [PubMed] [CrossRef] [Google Scholar] Pörtner et al. (2006) Пёртнер Х.О., Беннетт А.Ф., Бозинович Ф., Кларк А., Лардис М.А., Лукассен М., Пелстер Б., Шимер Ф., Стиллман Дж.Х. Компромиссы в тепловой адаптации: необходимость молекулярно-экологической интеграции. Физиологическая и биохимическая зоология. 2006;79(2):295–313. дои: 10.1086/499986. [PubMed] [CrossRef] [Google Scholar]Roznere et al. (2014) Рознере И., Уоттерс Г.Т., Вулф Б.А., Дейли М.Нецелевая метаболомика выявляет биохимические пути, измененные в ответ на содержание в неволе и ограничение пищи у пресноводных мидий Amblema plicata . Сравнительная биохимия и физиология. Часть D: Геномика и протеомика. 2014;12:53–60. doi: 10.1016/j.cbd.2014.09.004. [PubMed] [CrossRef] [Google Scholar] Сара и др. (2008) Сара Г., Романо С., Уиддоуз Дж., Стафф Ф.Дж. Влияние солености и температуры на физиологию питания и возможности роста инвазивных видов ( Brachidontes pharaonis —MOLLUSCA: BIVALVIA) в Средиземном море.Журнал экспериментальной морской биологии и экологии. 2008;363(1–2):130–136. doi: 10.1016/j.jembe.2008.06.030. [CrossRef] [Google Scholar] Saucedo et al. (2004) Saucedo PE, Ocampo L, Monteforte M, Bervera H. Влияние температуры на потребление кислорода и выделение аммиака у перламутровой устрицы Calafia, Pinctada mazatlanica (Hanley, 1856) Аквакультура. 2004; 229(1–4):377–387. doi: 10.1016/S0044-8486(03)00327-2. [CrossRef] [Google Scholar] Shin, Chan & Cheung (2014) Shin PKS, Chan CSK, Cheung SG.Физиологическая энергетика четвертого возраста китайских мечехвостов ( Tachypleus tridentatus ) в ответ на гипоксический стресс и реоксигенацию. Бюллетень о загрязнении морской среды. 2014;85(2):522–525. doi: 10.1016/j.marpolbul.2013.10.023. [PubMed] [CrossRef] [Google Scholar] Shumway (1982) Shumway SE. Потребление кислорода в устрицах: обзор. Письма по морской биологии. 1982;3(1):1–23. [Google Scholar] Sobral & Widdows (1997) Sobral P, Widdows J. Влияние повышенных температур на рост и устойчивость моллюска Ruditapes decussatus (L.), из южной Португалии. Сайентиа Марина. 1997;61(2):163–171. doi: 10.1023/A:1018435711128. [CrossRef] [Google Scholar]Соколова и др. (2012) Соколова И.М., Фредерих М., Багве Р., Ланниг Г., Сухотин А.А. Энергетический гомеостаз как интегративный инструмент для оценки пределов стрессоустойчивости водных беспозвоночных. Экологические исследования. 2012; 79:1–15. doi: 10.1016/j.marenvres.2012.04.00. [PubMed] [CrossRef] [Google Scholar]Солорзано (1969) Солорзано Л. Определение аммиака в природных водах фенолгипохлоритным методом.Лимнология и океанография. 1969; 14 (5): 799–801. doi: 10.4319/lo.1969.14.5.0799. [CrossRef] [Google Scholar]Sommer, Klein & Pörtner (1997) Sommer A, Klein B, Pörtner HO. Индуцированный температурой анаэробиоз в двух популяциях многощетинковых червей Arenicola marina (L.) Journal of Comparative Physiology B. 1997;167(1):25–35. doi: 10.1007/s003600050044. [CrossRef] [Google Scholar]Stickland & Parsons (1968) Stickland J, Parsons T. Практическое руководство по анализу морской воды. Бюллетень Канадского совета по рыболовству.1968; 55(1):167. doi: 10.1002/iroh.19700550118. [CrossRef] [Google Scholar] Tsugawa et al. (2011) Tsugawa H, Tsujimoto Y, Arita M, Bamba T, Fukusaki E. Метаболомика на основе ГХ/МС: разработка системы интеллектуального анализа данных для идентификации метаболитов с использованием мягкого независимого моделирования аналогии классов (SIMCA) BMC Bioinformatics. 2011;12(1):131. дои: 10.1186/1471-2105-12-131. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Verberk et al. (2013) Verberk WCEP, Sommer U, Davidson RL, Viant MR. Анаэробный метаболизм при экстремальных температурах: метаболическая проверка гипотезы ограничения кислорода у водных насекомых.Интегративная и сравнительная биология. 2013;53(4):609–619. doi: 10.1093/icb/ict015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]Vetter, Hwang & Hodson (1986) Vetter RD, Hwang HM, Hodson RE. Сравнение гликогеновых и адениновых нуклеотидов как индикаторов метаболического стресса у муммихосков. Труды Американского рыболовного общества. 1986;115(1):47–51. doi: 10.1577/1548-8659(1986)115<47:COGAAN>2.0.CO;2. [CrossRef] [Google Scholar] Витале и Фридл (1984) Витале М.А., Фридл Ф.Е. Производство аммиака пресноводными двустворчатыми моллюсками Elliptio buckleyi (LEA): интактные и одностворчатые препараты.Сравнительная биохимия и физиология Часть A: Физиология. 1984;77(1):113–116. doi: 10.1016/0300-9629(84)-5. [CrossRef] [Google Scholar] Wang et al. (2011) Ван И, Ху М, Вонг ВХ, Шин П.К., Чунг С.Г. Комбинированное влияние наличия кислорода и солености на физиологические реакции и возможности роста зеленогубой мидии Perna viridis . Бюллетень о загрязнении морской среды. 2011;63(5–12):255–261. doi: 10.1016/j.marpolbul.2011.02.004. [PubMed] [CrossRef] [Google Scholar] Wang et al.(2015) Wang YJ, Li L, Hu M, Lu W. Физиологическая энергетика толстопанцирной мидии Mytilus coruscus , подвергшейся воздействию подкисления морской воды и термического стресса. Наука о полной окружающей среде. 2015; 514: 261–272. doi: 10.1016/j.scitotenv.2015.01.092. [PubMed] [CrossRef] [Google Scholar] Wei et al. (2015) Wei L, Wang Q, Ning X, Mu C, Wang C, Cao R, Wu H, Cong M, Li F, Ji C, Zhao J. Комбинированный анализ метаболома и протеома ткани мантии тихоокеанской устрицы Crassostrea gigas , подвергшихся воздействию повышенного pCO 2 .Сравнительная биохимия и физиология. Часть D: Геномика и протеомика. 2015;13:16–23. doi: 10.1016/j.cbd.2014.12.001. [PubMed] [CrossRef] [Google Scholar] Widdows (1978) Widdows J. Физиологические показатели стресса у Mytilus edulis . Журнал Морской биологической ассоциации Великобритании. 1978; 58 (1): 125–142. doi: 10.1017/S0025315400024450. [CrossRef] [Google Scholar] Ян и др. (2017) Yang C, Gao Q, Liu C, Wang L, Zhou Z, Gong C, Zhang A, Zhang H, Qiu L, Song L. Транскрипционная реакция тихоокеанской устрицы, Crassostrea gigas , против острого теплового стресса .Иммунология рыбы и моллюсков. 2017; 68: 132–143. doi: 10.1016/j.fsi.2017.07.016. [PubMed] [CrossRef] [Google Scholar]You & Jiao (2011) You ZJ, Jiao HF. Исследование технологии экологической защиты и восстановления окружающей среды залива Сяншань. Пекин: China Ocean Press; 2011. С. 9–10. [на китайском языке] [Google Scholar] Young & Alfaro (2018) Young T, Alfaro AC. Метаболические стратегии для исследования аквакультуры: учебник для начинающих. Обзоры в аквакультуре. 2018;10(1):26–56. doi: 10.1111/raq.12146. [CrossRef] [Google Scholar] Юкихира, Лукас и Клумпп (2000) Юкихира Х., Лукас Дж. С., Клумпп Д. В.Сравнительное влияние температуры на питание суспензией и энергетический баланс жемчужниц Pinctada margaritifera и P. maxima . Серия Морская экология-Прогресс. 2000; 195:179–188. doi: 10.3354/meps195179. [CrossRef] [Google Scholar] Zhang et al. (2004) Zhang JH, Fang JG, Hawkins AJS, Pascoe PL. Влияние температуры на скорость клиренса и потребление кислорода морскими гребешками, Chlamys farreri . Журнал исследований моллюсков. 2004;23(3):715–721. [Google Scholar] Чжан и др.(2019) Zhang X, Shi J, Sun Y, Habib YJ, Yang H, Zhang Z, Wang Y. Интегративный анализ транскриптома и открытие генов, участвующих в иммунном ответе на гипоксию / термические воздействия у малого морского ушка Haliotis diversicolor . Иммунология рыбы и моллюсков. 2019; 84: 609–626. doi: 10.1016/j.fsi.2018.10.044. [PubMed] [CrossRef] [Google Scholar] Zhang et al. (2017) Zhang Y, Wu H, Wei L, Xie Z, Guan B. Эффекты гипоксии в жабрах манильского моллюска Ruditapes philippinarum с использованием метаболомики на основе ЯМР.Бюллетень о загрязнении морской среды. 2017;114(1):84–89. doi: 10.1016/j.marpolbul.
doi: 10.1111/j.1444-2906.2005.01040.x. [CrossRef] [Google Scholar] Нгуен и Альфаро (2019a) Нгуен ТВ, Альфаро AC. Применение омиков для исследования реакции гемоцитов двустворчатых моллюсков на патогенные инфекции и стресс окружающей среды.Аквакультура. 2019a doi: 10.1016/j.aquaculture.2019.734488. Epub перед печатью, 13 сентября 2019 г. [CrossRef] [Google Scholar] Нгуен и Альфаро (2019b) Нгуен ТВ, Альфаро AC. Целевая метаболомика для исследования антимикробной активности итаконовой кислоты у морских моллюсков. Метаболомика. 2019b;15(7):97. doi: 10.1007/s11306-019-1556-8. [PubMed] [CrossRef] [Google Scholar] Nguyen et al. (2018a) Нгуен Т.В., Альфаро А.С., Мериен Ф., Лулийва Р., Янг Т. Медь-индуцированная иммуномодуляция в гемоцитах мидий ( Perna canaliculus ).Металломика. 2018а; 10(7):965–978. doi: 10.1039/C8MT00092A. [PubMed] [CrossRef] [Google Scholar] Nguyen et al. (2018b) Нгуен Т.В., Альфаро А.С., Мериен Ф., Янг Т., Грандиоза Р. Метаболические и иммунологические реакции самцов и самок новозеландских мидий Greenshell™ ( Perna canaliculus ), инфицированных Vibrio sp. Журнал патологии беспозвоночных. 2018b;157:80–89. doi: 10.1016/j.jip.2018.08.008. [PubMed] [CrossRef] [Google Scholar] Nguyen et al. (2019) Нгуен ТВ, Альфаро АС, Янг Т, Мериен Ф.Тканеспецифические иммунные ответы на Vibrio sp. инфекция у мидий ( Perna canaliculus ): метаболомический подход. Аквакультура. 2019;500:118–125. doi: 10.1016/j.aquaculture.2018.09.061. [CrossRef] [Google Scholar] Нгуен и др. (2018c) Нгуен Т.В., Альфаро А.С., Янг Т., Рави С., Мериен Ф. Метаболомическое исследование иммунных реакций новозеландских мидий greenshell™ ( Perna canaliculus ), инфицированных патогенными Vibrio sp. Морская биотехнология. 2018c;20(3):396–409.doi: 10.1007/s10126-018-9804-x. [PubMed] [CrossRef] [Google Scholar]Nie et al. (2017) Ни Х.Т., Лю Л.Х., Хо З.М., Чен П., Дин Дж.Ф., Ян Ф., Ян XW. Реакция экспрессии гена HSP70 на температурный и солевой стресс у диких и культивируемых манильского моллюска Ruditapes philippinarum . Аквакультура. 2017; 470:149–156. doi: 10.1016/j.aquaculture.2016.12.016. [CrossRef] [Google Scholar]Pernet et al. (2007) Pernet F, Tremblay R, Comeau L, Guderley H. Температурная адаптация у двух видов двустворчатых моллюсков из разных тепловых мест обитания: энергетика и ремоделирование мембранных липидов.Журнал экспериментальной биологии. 2007;210(17):2999–3014. doi: 10.1242/jeb.006007. [PubMed] [CrossRef] [Google Scholar] Pernet et al. (2008) Pernet F, Tremblay R, Redjah I, Sevigny JM, Gionet C. Физиологические и биохимические признаки коррелируют с различиями в скорости роста и температурной адаптации среди групп восточной устрицы Crassostrea virginica . Журнал экспериментальной биологии. 2008;211(6):969–977. doi: 10.1242/jeb.014639. [PubMed] [CrossRef] [Google Scholar] Пирс (1982) Пирс С.Механизмы контроля объема клеток беспозвоночных: скоординированное использование внутриклеточных аминокислот и неорганических ионов в качестве осмотического раствора. Биологический вестник. 1982;163(3):405–419. дои: 10.2307/1541452. [CrossRef] [Google Scholar] Престон (1993) Престон Р.Л. Транспорт аминокислот морскими беспозвоночными. Журнал экспериментальной зоологии. 1993;265(4):410–421. doi: 10.1002/jez.1402650410. [CrossRef] [Google Scholar] Pörtner (2010) Pörtner HO. Ограничение кислорода и мощности термоустойчивости: amatrix для интеграции стрессовых воздействий, связанных с климатом, в морских экосистемах.Журнал экспериментальной биологии. 2010;213(6):881–893. doi: 10.1242/jeb.037523. [PubMed] [CrossRef] [Google Scholar] Pörtner et al. (2006) Пёртнер Х.О., Беннетт А.Ф., Бозинович Ф., Кларк А., Лардис М.А., Лукассен М., Пелстер Б., Шимер Ф., Стиллман Дж.Х. Компромиссы в тепловой адаптации: необходимость молекулярно-экологической интеграции. Физиологическая и биохимическая зоология. 2006;79(2):295–313. дои: 10.1086/499986. [PubMed] [CrossRef] [Google Scholar]Roznere et al. (2014) Рознере И., Уоттерс Г.Т., Вулф Б.А., Дейли М.Нецелевая метаболомика выявляет биохимические пути, измененные в ответ на содержание в неволе и ограничение пищи у пресноводных мидий Amblema plicata . Сравнительная биохимия и физиология. Часть D: Геномика и протеомика. 2014;12:53–60. doi: 10.1016/j.cbd.2014.09.004. [PubMed] [CrossRef] [Google Scholar] Сара и др. (2008) Сара Г., Романо С., Уиддоуз Дж., Стафф Ф.Дж. Влияние солености и температуры на физиологию питания и возможности роста инвазивных видов ( Brachidontes pharaonis —MOLLUSCA: BIVALVIA) в Средиземном море.Журнал экспериментальной морской биологии и экологии. 2008;363(1–2):130–136. doi: 10.1016/j.jembe.2008.06.030. [CrossRef] [Google Scholar] Saucedo et al. (2004) Saucedo PE, Ocampo L, Monteforte M, Bervera H. Влияние температуры на потребление кислорода и выделение аммиака у перламутровой устрицы Calafia, Pinctada mazatlanica (Hanley, 1856) Аквакультура. 2004; 229(1–4):377–387. doi: 10.1016/S0044-8486(03)00327-2. [CrossRef] [Google Scholar] Shin, Chan & Cheung (2014) Shin PKS, Chan CSK, Cheung SG.Физиологическая энергетика четвертого возраста китайских мечехвостов ( Tachypleus tridentatus ) в ответ на гипоксический стресс и реоксигенацию. Бюллетень о загрязнении морской среды. 2014;85(2):522–525. doi: 10.1016/j.marpolbul.2013.10.023. [PubMed] [CrossRef] [Google Scholar] Shumway (1982) Shumway SE. Потребление кислорода в устрицах: обзор. Письма по морской биологии. 1982;3(1):1–23. [Google Scholar] Sobral & Widdows (1997) Sobral P, Widdows J. Влияние повышенных температур на рост и устойчивость моллюска Ruditapes decussatus (L.), из южной Португалии. Сайентиа Марина. 1997;61(2):163–171. doi: 10.1023/A:1018435711128. [CrossRef] [Google Scholar]Соколова и др. (2012) Соколова И.М., Фредерих М., Багве Р., Ланниг Г., Сухотин А.А. Энергетический гомеостаз как интегративный инструмент для оценки пределов стрессоустойчивости водных беспозвоночных. Экологические исследования. 2012; 79:1–15. doi: 10.1016/j.marenvres.2012.04.00. [PubMed] [CrossRef] [Google Scholar]Солорзано (1969) Солорзано Л. Определение аммиака в природных водах фенолгипохлоритным методом.Лимнология и океанография. 1969; 14 (5): 799–801. doi: 10.4319/lo.1969.14.5.0799. [CrossRef] [Google Scholar]Sommer, Klein & Pörtner (1997) Sommer A, Klein B, Pörtner HO. Индуцированный температурой анаэробиоз в двух популяциях многощетинковых червей Arenicola marina (L.) Journal of Comparative Physiology B. 1997;167(1):25–35. doi: 10.1007/s003600050044. [CrossRef] [Google Scholar]Stickland & Parsons (1968) Stickland J, Parsons T. Практическое руководство по анализу морской воды. Бюллетень Канадского совета по рыболовству.1968; 55(1):167. doi: 10.1002/iroh.19700550118. [CrossRef] [Google Scholar] Tsugawa et al. (2011) Tsugawa H, Tsujimoto Y, Arita M, Bamba T, Fukusaki E. Метаболомика на основе ГХ/МС: разработка системы интеллектуального анализа данных для идентификации метаболитов с использованием мягкого независимого моделирования аналогии классов (SIMCA) BMC Bioinformatics. 2011;12(1):131. дои: 10.1186/1471-2105-12-131. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Verberk et al. (2013) Verberk WCEP, Sommer U, Davidson RL, Viant MR. Анаэробный метаболизм при экстремальных температурах: метаболическая проверка гипотезы ограничения кислорода у водных насекомых.Интегративная и сравнительная биология. 2013;53(4):609–619. doi: 10.1093/icb/ict015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]Vetter, Hwang & Hodson (1986) Vetter RD, Hwang HM, Hodson RE. Сравнение гликогеновых и адениновых нуклеотидов как индикаторов метаболического стресса у муммихосков. Труды Американского рыболовного общества. 1986;115(1):47–51. doi: 10.1577/1548-8659(1986)115<47:COGAAN>2.0.CO;2. [CrossRef] [Google Scholar] Витале и Фридл (1984) Витале М.А., Фридл Ф.Е. Производство аммиака пресноводными двустворчатыми моллюсками Elliptio buckleyi (LEA): интактные и одностворчатые препараты.Сравнительная биохимия и физиология Часть A: Физиология. 1984;77(1):113–116. doi: 10.1016/0300-9629(84)-5. [CrossRef] [Google Scholar] Wang et al. (2011) Ван И, Ху М, Вонг ВХ, Шин П.К., Чунг С.Г. Комбинированное влияние наличия кислорода и солености на физиологические реакции и возможности роста зеленогубой мидии Perna viridis . Бюллетень о загрязнении морской среды. 2011;63(5–12):255–261. doi: 10.1016/j.marpolbul.2011.02.004. [PubMed] [CrossRef] [Google Scholar] Wang et al.(2015) Wang YJ, Li L, Hu M, Lu W. Физиологическая энергетика толстопанцирной мидии Mytilus coruscus , подвергшейся воздействию подкисления морской воды и термического стресса. Наука о полной окружающей среде. 2015; 514: 261–272. doi: 10.1016/j.scitotenv.2015.01.092. [PubMed] [CrossRef] [Google Scholar] Wei et al. (2015) Wei L, Wang Q, Ning X, Mu C, Wang C, Cao R, Wu H, Cong M, Li F, Ji C, Zhao J. Комбинированный анализ метаболома и протеома ткани мантии тихоокеанской устрицы Crassostrea gigas , подвергшихся воздействию повышенного pCO 2 .Сравнительная биохимия и физиология. Часть D: Геномика и протеомика. 2015;13:16–23. doi: 10.1016/j.cbd.2014.12.001. [PubMed] [CrossRef] [Google Scholar] Widdows (1978) Widdows J. Физиологические показатели стресса у Mytilus edulis . Журнал Морской биологической ассоциации Великобритании. 1978; 58 (1): 125–142. doi: 10.1017/S0025315400024450. [CrossRef] [Google Scholar] Ян и др. (2017) Yang C, Gao Q, Liu C, Wang L, Zhou Z, Gong C, Zhang A, Zhang H, Qiu L, Song L. Транскрипционная реакция тихоокеанской устрицы, Crassostrea gigas , против острого теплового стресса .Иммунология рыбы и моллюсков. 2017; 68: 132–143. doi: 10.1016/j.fsi.2017.07.016. [PubMed] [CrossRef] [Google Scholar]You & Jiao (2011) You ZJ, Jiao HF. Исследование технологии экологической защиты и восстановления окружающей среды залива Сяншань. Пекин: China Ocean Press; 2011. С. 9–10. [на китайском языке] [Google Scholar] Young & Alfaro (2018) Young T, Alfaro AC. Метаболические стратегии для исследования аквакультуры: учебник для начинающих. Обзоры в аквакультуре. 2018;10(1):26–56. doi: 10.1111/raq.12146. [CrossRef] [Google Scholar] Юкихира, Лукас и Клумпп (2000) Юкихира Х., Лукас Дж. С., Клумпп Д. В.Сравнительное влияние температуры на питание суспензией и энергетический баланс жемчужниц Pinctada margaritifera и P. maxima . Серия Морская экология-Прогресс. 2000; 195:179–188. doi: 10.3354/meps195179. [CrossRef] [Google Scholar] Zhang et al. (2004) Zhang JH, Fang JG, Hawkins AJS, Pascoe PL. Влияние температуры на скорость клиренса и потребление кислорода морскими гребешками, Chlamys farreri . Журнал исследований моллюсков. 2004;23(3):715–721. [Google Scholar] Чжан и др.(2019) Zhang X, Shi J, Sun Y, Habib YJ, Yang H, Zhang Z, Wang Y. Интегративный анализ транскриптома и открытие генов, участвующих в иммунном ответе на гипоксию / термические воздействия у малого морского ушка Haliotis diversicolor . Иммунология рыбы и моллюсков. 2019; 84: 609–626. doi: 10.1016/j.fsi.2018.10.044. [PubMed] [CrossRef] [Google Scholar] Zhang et al. (2017) Zhang Y, Wu H, Wei L, Xie Z, Guan B. Эффекты гипоксии в жабрах манильского моллюска Ruditapes philippinarum с использованием метаболомики на основе ЯМР.Бюллетень о загрязнении морской среды. 2017;114(1):84–89. doi: 10.1016/j.marpolbul.
 Можно запаривать перловку в термосе;
Можно запаривать перловку в термосе;